
Стафилококкоз
Стафилококковое заболевание кроликов впервые наблюдал Земмер в 1881 г., а затем его неоднократно описывали многие авторы под различными названиями, в зависимости от локализации и характера поражений. В 1940 и 1952 гг. П. П. Сахаров объединил под названием стафилококкоз кроликов септикопиемию новорожденных крольчат, бродячую (блуждающую) пиемию, мастит, стафилококковый пододерматит, параличи стафилококковой этиологии, гнойный катар челюсти и серозный ринит. С. В. Леонтюк (1959) считает, что нет оснований две последние болезни относить к стафилококкозу, что стафилококковый пододерматит следует рассматривать как секундарную стафилококковую инфекцию, осложняющую первичное заболевание (пододерматит); дополнительно к стафилококкозу необходимо отнести стафилококковую септицемию.
Этиология. Возбудители болезни - Staphylococcus pyogenes aureus, реже albus (Rosenbach, 1884) принадлежат к роду Staphylococcus, семейству Micrococcaceae, порядку Eubacteriales. классу Schizomycetes. Это аэробы. Они неподвижны, форма их шарообразная; диаметр St. pyogenes aureus - 0,5 - 0,8 мкм, St. pyogenes albus - 0.8 - 1 мкм. Располагаются они обычно в виде гроздей винограда Спор не образуют. Хорошо растут на обычных питательных средах Оптимальный рост при 37°, рН 7 - 7,2. На бульоне образуют сильную муть. На агаре St. pyogenes aureus образует отдельные или сливающиеся блестящие или матовые колонии золотистого, желтого или оранжевого цвета; St. pyogenes albus - гладкие, блестящие, нередко сливающиеся, белые, беловато-серые или бесцветные колонии. Грампозитивны.
Желатин разжижают; молоко свертывают, некоторые штаммы пептонизируют. Образуют кислоту без газа на глюкозе, манните, глицерине, a St. pyogenes albus, кроме того, - на лактозе и сахарозе.
Стафилококки весьма устойчивы к воздействию внешних факторов и химических веществ, отдельные штаммы обладают разной устойчивостью. Солнечные лучи, по данным Распе, не убивают их, по сведениям других авторов - убивают через 3 - 5 часов. При высушивании они выживают несколько месяцев, долго сохраняются в пыли. Высушивание в мелких пылинках губит их через 28 дней (Кирштейн). По данным Пачке, при температуре 50° они гибнут через 1 - 1/2 часа, при 60° - через 5 - 10 минут, при 70° - через 10 - 20 секунд; по Штернбергу, при 62° - через 10, при 80° - через 1 - 5 минут; по Нейссеру, при 60° - через 30 - 45, при 70° - через 5 минут, температура минус 30° не вы зывает их гибели; по Фишеру, большинство из них теряет вирулентность при 52 - 53° через 2 - 3 часа. 1%-ный раствор формалина губит их через 24 часа, 3%-ный - через 1 час; 1%-ный раствор карболовой кислоты - через 10 - 15 минут, старые культуры - через 35 минут. Стафилококки чувствительны к ряду антибиотиков: пенициллину, стрептомицину, тетрациклину, окситетрациклину, ауреомицину, синтомицину, левомицетину и др.
St. pyog. aureus продуцирует экзопенициллазу, связанную с клеточной стенкой; патогенные штаммы, как правило, - коагулазу, которая вызывает коагуляцию плазмы (N. W. Coles и R. Gross, 1967). Культуры St. pyog. aureus, выделенные при гнойных процессах у животных, ферментируют маннит и лактозу, большинство из них гемолизирует эритроциты и коагулирует плазму. Плазмокоагулирующие культуры обнаруживают фактор распространения и дают положительную пробу по Дольду (М. Д. Жукова, 1949).
Патогенные стафилококки образуют токсины, обладающие различным действием на организм. Штаммы, выделенные от больных кроликов, образуют а- и 3-токсины и, кроме того, 35% из них - токсин б (С. В. Леонтюк, 1970). Штаммы, выделяемые от других животных, образуют преимущественно токсин 8, некоторые - термостабильный энтеротоксин (А. Г Осташевский, 1956, и др.). Штаммы, выделяемые от больных людей, вырабатывают токсин а и большинство - токсин б (К П. Конова, 1965; А. К. Акатов, 1969; Е. В. Русакова, 1971); некоторые штаммы образуют летальные термолабильные токсины (А. К. Акатов, 1972). Многие стафилококки образуют лейкоцидин, разрушающий лейкоциты, и флагозин, вызывающий некроз кожи.
Токсин а гемолизирует эритроциты кролика, обладает дермонекротическими свойствами и нередко вызывает гибель животного. Токсин β гемолизирует эритроциты барана в течение одного часа при температуре 37° и 18 - 20 часов при 2 - 4°. Токсин б гемолизирует эритроциты кролика и человека, вызывает некроз кожи и гибель кроликов и мышей при внутривенном введении (Е. В. Русакова, 1971). Энтеротоксин обладает нейтротоксическим действием; не разрушается ферментами пищеварительного тракта (А. Г. Осташевский, 1956). Все токсины обладают антигенной активностью и играют роль в патогенезе заболевания.
По данным В. В. Ковалевой (1961), стафилококковый токсин образует в реакции преципитации 3 - 8 линий, т. е. имеет сложную антигенную структуру. Методом двойной диффузной преципитации автор выявила наличие 2 - 3 общих для всех стафилококковых токсинов антигенов, другие антигенные компоненты встречаются непостоянно.
По данным Г. Н. Чистовича (1955 - 1956), стафилококковый токсин образует 10 зон преципитации.
Стафилококки образуют 22 типа бактериофагов, которые разделяются на пять основных групп. Стафилококки, выделяемые от кроликов, по нашим данным, чаще всего относятся к первой и третьей фагогруппам. Против стафилококков первой фагогруппы очищенный сорбированный анатоксин (а) создает напряженный иммунитет, против третьей - слабый (А. К. Акатов и К. Р. Толовская, 1971).
Стафилококки состоят из капсулы (некоторые штаммы St. руog. aureus), клеточной стенки, цитоплазматических мембран, цитоплазмы и ядерного аппарата. Капсула выполняет антифагоцитарную функцию; основным компонентом ее является аминоглюкуроновая кислота. Стенка состоит из двух слоев: поверхностного - белковый А-антиген (агглютиноген) и внутреннего, состоящего из комплекса мукопептида и тейхоевой кислоты (St. I. Morse, 1962, 1963, 1965). В стенке St. pyog. aureus содержатся и другие антигены, образующие мозаичную их структуру. Иммунохимическими методами обнаружены белок А, антиген п, гемосензитины в отношении нативных и тонизированных эритроцитов барана и типовые агглютиногены (A. Grov, S. Rude, 1967); в культуральной жидкости - пептидный компонент, состоящий из D-глутаминовой кислоты, D- и L-аланина, L-лизина и глицина, мукопептидный компонент (К. Hisatkune, Da Coеrcy, I. S. I. Mudds, 1967).
В стенке St. pyog. albus, кроме группового полисахарида А, обнаружен типоспецифический антигенный компонент белковой природы.
Антигенная активность полисахаридного компонента детерминируется глюкозой, связанной с глицерофосфатом (A. Voshide и др., 1961).
В химический состав мембраны входят фосфат глицерол и некоторые липоаминскислоты (Н. Ward, Perkins, 1968).
Внутриклеточные структуры содержат неспецифические антигенные комплексы белковой или нуклеопротеиновой природы.
Из стафилококков третьей фагогруппы выделен протективный соматический ПС-антиген, иммуногенность которого наиболее высока к стафилококкам этой фагогруппы (А. "К. Акатов, К. Р. Толовская, 1971). У St. pyog. aureus различают группоспецифические антигены: полисахарид А - рибитолтейхоевая кислота с Р - глюкозами-ном, полисахарид 263 - рибитолтейхоевая кислота с а - глюкозамином, белок А (А-антиген), белковый антиген и типоспецифические антигены - более 30 агглютиногенов белковой природы.
Антиген А обусловливает агглютинацию целых клеток, разрушается трипсином Антитела к нему имеются у всех здоровых людей, но у кроликов их нет. Антиген А не играет существенной роли в патогенезе (St. I Morse, 1962, 1963, 1965).
Полисахарид А (тейхоевая кислота) - специфический преципитоген, является полимером, состоящим из субъединиц полирибитол-фосфата, к которым присоединены D-аданин и N-ацетилглюкозамин. Последний является его антигенным детерминантом (G. Наnkenes, 1962; St. I. Morse, 1965). В опытах на мышах он оказывает выраженное протективное действие (R. D. Eksted, 1965; Т. Shimizu, 1965). Пептидный компонент активен в реакциях преципитации. Мукопептидный компонент обусловливает ригидность стенки и является местом прикрепления бактериофага.
Клеточные стенки и целые микробы стимулируют синтез антител, которые защищают от инфекции; гидролизат из клеточных стенок защищает против стафилококковых абсцессов, экстракт без стенок и культуральная жидкость не обладают протективной активностью. У бескапсульных стафилококков наилучшим протективным действием обладает соматический антиген (надосадочная жидкость, полученная после 9-дневного лизиса микробов при температуре 37°). Клеточные стенки и целые клетки вызывают резкие воспалительные процессы (Т. Shimizu, 1965).
Восприимчивость. К стафилококковой инфекции восприимчивы все животные и человек; особенно чувствительны кролики.
Эпизоотология. Болезнь зарегистрирована повсеместно. Особенно часто болеют кролики. Стафилококки широко распространены во внешней среде - они имеются всюду: в воздухе, воде, кормах, помещениях, в том числе в кроличьих клетках, на коже и слизистых оболочках животных. Однако большинство из них не патогенно и не играет заметной роли в эпизоотологии болезни. Опасность представляют патогенные стафилококки, особенно высокотоксиногенные. Основным источником их распространения являются больные и имевшие с ними контакт животные, а также предметы, с которыми они соприкасались. Ввиду большой устойчивости стафилококков к воздействиям факторов внешней среды и дезинфицирующих средств накопление и распространение их в хозяйстве происходят довольно быстро, что приводит к стационарному его неблагопо лучию. Стафилококки проникают в организм через поврежденные кожу и слизистые оболочки или через воспаленные слизистые оболочки.
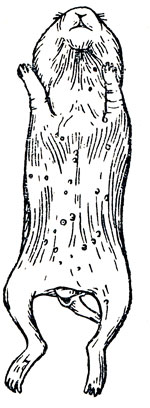
Рис. 10 Пиодермия Гнойнички в коже крольчонка
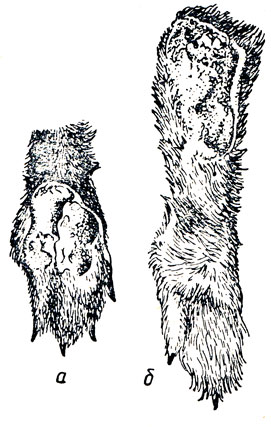
Рис. 11. Секундарная стафилококковая инфекция. Гноящиеся язвы на ступне: 1 - передней: 2 - задней конечности
Основными факторами, способствующими возникновению и распространению болезни, являются: наличие в стаде больных стафилококкозом кроликов; антисанитарное содержание, наличие острых, незагнутых концов проволоки и гвоздей в клетках, несглаженных краев лаза в маточники и других предметов, о которые могут пораниться кролики; скученное содержание их. приводящее к дракам, оставление большого количества крольчат под маломолочными самками, что приводит к покусам их сосков. Маститы у крольчих чаще всего возникают с 8-го до 18-й день лактации и распространение их носит гнездныи характер: заболевает группа самок, размещенных вблизи первой заболевшей и не удаленной из стада (С. В. Леонтюк).
Инкубационный период болезни 2 - 5 дней.
Патогенез. Чаще всего стафилококки размножаются в месте внедрения или заноса током крови или лимфы, размножаются, вырабатывают токсины и вызывают воспалительный процесс. В очаг инфекции устремляется большое количество лейкоцитов, часть из них гибнет от действия лейкоцидина. Вокруг очага инфекции образуется плотная соединительнотканая капсула, которая изолирует его от организма. Локализированный под кожей инкапсулированный абсцесс не влияет на общее состояние кролика; при локализации во внутренних органах сдавливает их ткани, что снижает их функции, однако клинически обычно не замечается. Через 1 - 3 месяца инкапсулированные абсцессы самопроизвольно вскрываются. Подкожные - обычно наружу; при этом разрывается истонченная кожа над ними и стафилококки из гноя попадают в разорванные кровеносные сосуды кожи и с кровью заносятся в другие места тела, вследствие чего образуются новые абсцессы. Внутренние абсцессы вскрываются в ту или иную полость, в результате чего кролики быстро гибнут от септицемии и интоксикации.
При попадании большого количества стафилококков в кровь, они разносятся по всему организму, что приводит к развитию множества очагов инфекции во всех органах и тканях и быстрой гибели кролика. При попадании в толщу кожи, что чаще всего бывает у новорожденных крольчат (поверхностные ранения о жесткую подстилку гнезда), в местах внедрения стафилококков развиваются гнойнички. Обычно их много, поэтому крольчата быстро гибнут.

Рис. 12. Стафилококкоз. Абсцесс под кожей
Проникнув в мелочную железу, стафилококки вызывают в ней гнойное воспаление. Как секундарная инфекция стафилококки часто осложняют пододерматит гнойным и некротическим процессами.
Симптоматика. Клинически стафилококкоз проявляется различно и в зависимости от течения по-разному называется.
Септикопиемия новорожденных крольчат (впервые описана С. В. Леонтюком в 1934 г.; правильнее ее называть пиодермией) - в коже крольчат 1 - 3-дневного возраста обнаруживают многочисленные величиной с просяное зерно гнойнички (рис. 10, 11); через несколько дней крольчата обычно погибают.
Блуждающая (бродячая) пиемия - в каком-либо месте тела, чаще всего под кожей губ, головы, бока, спины, находят резко отграниченный флюктуирующий абсцесс величиной от горошины до яблока (рис. 12); иногда наблюдают выпячивание глаза вследствие образования абсцесса за глазным яблоком. При абсцессе в мозге выражен паралич той или другой части тела, чаще задних конечностей.
Мастит - вначале обнаруживают покраснение и отечность пораженной доли молочной железы, затем ее затвердение. При выдавливании из соска выделяется густое с примесью гноя молоко или гной. Нередко наблюдают абсцессы под кожей пораженной доли железы; они самопроизвольно вскрываются, образуются медленно заживающие язвы.
Септицемия - наблюдают учащенное дыхание, повышение температуры тела до 41 - 42°, угнетение и гибель кролика.
Осложнение пододерматита стафилококковой инфекцией - обнаруживают нагноение язв, идущие от них гнойные свищи, иногда обильно кровоточащую грануляционную ткань.
Патологоанатомические изменения. На вскрытии при блуждающей пиемии находят один или несколько инкапсулированных абсцессов под кожей или во внутренних органах; при мастите - гнойные очаги в молочной железе; при септицемии - множественные абсцессы величиной до гречневого зерна в мышцах и более крупные во внутренних органах, чаще всего в почках, легких, печени; либо - скопление гноя в грудной или брюшной полости и вскрывшийся в нее гнойник, покраснение, иногда отечность легких, увеличение селезенки, покраснение и увеличение лимфатических узлов.
При гистологическом исследовании обнаруживают пролиферацию ретикулоэндотелия сосудов селезенки, печени, почек, сердца и легких; зернистую дистрофию извитых канальцев почек, клеток печени и отдельных мышечных волокон миокарда; лимфоидную инфильтрацию под эпендимой боковых желудочков мозга. Кроме того, при пиодермии - расширенные, наполненные гноем, содержащим стафилококков, волосяные мешочки и небольшие скопления псевдоэозинофилов по ходу внутридольковых капилляров печени; при блуждающей пиемии - большие очаговые скопления лимфоидных клеток около боковых желудочков мозга (В. В. Титов, 1958).
Диагноз. Признаки болезни при внутрикожной или подкожной локализации гнойников или язв настолько характерны, что поставить диагноз не представляет затруднений.
Внутренние абсцессы диагностируются только при вскрытии.
Дифференциальный диагноз. Необходимо иметь в виду, что инкапсулированные абсцессы могут быть при атипичной форме пастереллеза, а изменения при стафил9кокковой септицемии могут быть сходны с изменениями, обнаруживаемыми при других септииемиях, поэтому окончательный диагноз ставят на основании бактериологического исследования.
Лечение. При пиодермии внутримышечно вводят бициллин в дозе 30 000 - 50 000 ЕД и ежедневно смазывают гнойнички на коже 3%-ным раствором карболовой кислоты или 5°/р-ным спиртовым раствором бриллиантовой зелени.
При блуждающей пиемии шерсть над подкожным абсцессом остригают, кожу дезинфицируют и осторожно, чтобы не повредить капсулу абсцесса, разрезают. Стерильным пинцетом или ручкой скальпеля капрулу отделяют от окружающей ткани и вынимают (вылущивают) абсцесс. Полость промывают раствором риванола, перекиси водорода или другого дезинфицирующего средства, рану присыпают или смазывают дезинфицирующим порошком или мазью. Если абсцесс вылущить не удается, то края разреза кожи смазывают настойкой йода, после прекращения кровотечения разрезают капсулу абсцесса и осторожно, чтобы не пачкать гноем края разреза кожи, удаляют из нее гной. Полость и рану обрабатывают, как указано выше. Внутримышечно один раз вводят бициллин или 2 - 3 дня подряд по 2 раза в день пенициллин или стрептомицин в дозах 15 000 - 20 000 ЕД на 1 кг веса кролика.
При мастите. В начале болезни (гиперемия, набухание, затвердение) втирают в пораженные доли молочной железы камфорную, прополисовую, йодисто-калиевую или ихтиоловую мазь, вводят бициллин раз в 2 - 3 дня, пенициллин или стрептомицин 4 - 5 дней по 2 раза в день в дозах 15 000 - 20 000 ЕД на 1 кг веса кролика. При образовании гнойника его вскрывают, раневую полость обрабатывают, внутримышечно вводят антибиотики.
При секундарной стафилококковой инфекции при пододерматите очищают язвы и свищевые ходы, некротизированную ткань удаляют, смазывают пораженную поверхность настойкой йода и после прекращения кровотечения накладывают повязку с пенициллиновой или стрептомициновой мазью; повязку сменяют через каждые 2 - 3 дня. Если больной кролик находится в клетке с сетчатым полом, кладут реечный или сплошной пол или мягкую подстилку.
Меры борьбы и профилактика. Основное внимание должно быть уделено недопущению заноса и накопления на ферме патогенных стафилококков, их уничтожению и устранению факторов, способствующих возникновению болезни. Необходимо ежедневно наблюдать за состоянием кроликов и в первые дни после окрола осматривать крольчат и молочные железы самок. При обнаружении клинических признаков стафилококкоза в любой форме его проявления (в том числе и секундарной инфекции при пододерматите), немедленно удаляют из стада заболевшего кролика и всех находящихся с ним в клетке, тщательно дезинфицируют эту и соседние с ней клетки, очищают их, навоз, остатки корма и подстилку из них вывозят и сжигают или подвергают биотермической обработке, и затем повторно дезинфицируют клетки. При обнаружении у лактирующих самок покусов сосков ежедневно 2 - 3 раза смазывают их пенициллиновой, стрептомициновой, прополисовой или цинковой мазью, проверяют молочность самок и соответствие ей количества оставленных под самкой крольчат. Если самка маломолочна, часть ее крольчат нужно подложить в гнезда молочных самок. При выявлении у самки нагноения сосков или мастита ее вместе с крольчатами удаляют из стада и делают дезинфекцию, как указано выше. При выявлении большого количества маломолочных самок необходимо улучшить их кормление, в частности увеличить дачу сочных кормов. При обнаружении застоя молока нужно удалить его из набухших долей железы, для чего подносят к ним крольчат и следят за тем, чтобы они отсосали его. Если у таких самок мало крольчат, подсаживают к ней несколько крольчат от маломолочных самок. Подсаживать можно только здоровых крольчат от здоровых самок.
Для предупреждения повреждений кожи кроликов, что способствует проникновению инфекции (входные ворота), необходимо систематически проверять клетки устранять острые предметы, о которые могут пораниться кролики, проверять, хорошо ли выстланы пухом гнезда, если плохо - поправить; следить за поведением отсаженных крольчат: при выявлении среди них драчунов - изолировать их; не допускать скученности при размещении крольчат - это способствует возникновению драк между ними.
В хозяйствах, где наблюдается значительная заболеваемость самок маститом, следует систематически им мунизировать их стафилококковым анатоксином, предложенным С. В. Леонтюком (1971). Вакцинируют самок двукратно на 10 - 12-й и 15 - 17-й день беременности в дозах 0,5 и 1 мл; при последующих беременностях- однократно в дозе 1 мл на 15 - 17-й день. При первой вакцинации создается иммунитет длительностью 1 - 1 1/2 месяца, при последующих - 1 1/2 - 2 1/2 месяца. Вакцинация обеспечивает иммунитет в период наибольшей о заболеваемости крольчих и снижает поражение маститом в 3 - 4 раза. Анатоксин изготовляют в Научно-исследовательском институте пушного звероводства и кролиководства и применяют в порядке широкого опыта.
Для дезинфекции применяют: 4%-ный раствор формальдегида (t 16 - 20°, экспозиция 2 часа); 2%-ный раствор хлорамина (t 40 - 55°, экспозиция 3 часа); 8%-ный раствор демпа (t 60 - 80°, экспозиция 3 часа); 5%-ный раствор кальцинированной соды (t 80 - 90°, экспозиция 4 часа); 10%-ный раствор кальцинированной соды (t 80 - 90°, экспозиция 2 часа); 0,5%-ный раствор трироризоционуровой кислоты (t 16 - 20°, экспозиция 2 часа); 3%-ный раствор едкого натрия (t 50 - 60°, [экспозиция 3 часа).
В. Вачугов в 1971 - 1972 гг. применял при стафилококкозе кроликов дезинфекцию закрытых крольчатников с находящимися в них кроликами путем распыления при помощи ДУК 1%-ного раствора хлорамина с добавлением к нему в качестве активатора для повышения бактерицидности 1% аммония (в порошке) и получил удовлетворительные результаты, однако он недостаточно обстоятельно и всесторонне их изучил.
Н. П. Сырникова в 1971 - 1973 гг. разработала и рекомендует следующие методы дезинфекции при стафилококкозе кроликов:
при отсутствии кроликов в помещениях - а) обычную влажную дезинфекцию следующими растворами: 4%-ным раствором формальдегида, экспозиция 2 часа; 2%-ным раствором хлорамина (40 - 45°), экспозиция 3 часа; 0,5%-ным раствором трихлоризоциануровой кислоты, экспозиция 2 часа; 2%-ным раствором дезмола, экспозиция 3 часа; 8%-ным раствором демпа (60 - 70°), экспозиция 4 часа; б) аэрозольную дезинфекцию - 25%-ным раствором формальдегида из расчета 20 мл/м3 (в больших помещениях или при недостаточной герметизации - 30 - 40 мл/м3), экспозиции 6 часов; 10%-ным раствором натриевой соли дихлоризоциануровой кислоты из расчета 15 мл/м3, экспозиция 4 часа, 10%-ным раствором перекиси водорода из расчета 100 мл/м3, экспозиция 2 часа;
при наличии кроликов в помещениях - а) обычную влажную дезинфекцию 1%-ным раствором хлорамина, активированного добавлением 0,5% нашатырного спирта, экспозиция 3 часа; 3%-ным раствором перекиси водорода с 1 % уксусной кислоты, экспозиция 1 час; 2%-ным раствором дезмола, экспозиция 3 часа; б) направленными аэрозолями - 5%-ным раствором перекиси водорода с 1 % уксусной кислоты из расчета 150 мл/м2, экспозиция 1 час; раствором гипохлора, содержащим 2% активного хлора из расчета 150 мл/м2, экспозиция 1 час; в) дезинфекцию воздуха аэрозольным методом - растворами молочной кислоты из расчета 20 мг чистого вещества на 1 м3, экспозиция 20 минут, 5%-ным раствором перекиси водорода из расчета 15 мг чистого вещества на 1 м3, экспозиция 20 минут (при большом объеме помещения или плохой герметизации расход увеличивают на 5 - 10 мг/м3, экспозицию до 30 минут); г) комбинированная дезинфекция - обеззараживание поверхностей обычной влажной дезинфекцией или направленными аэрозолями; воздуха - растворами молочной кислоты или перекиси водорода.
Ввоз и вывоз больных стафилококкозом кроликов запрещаются. Тушки убитых кроликов с невскрывшимися или вскрывшимися наружу единичными абсцессами после удаление пораженных мест используют впишу людям. Тушки убитых и павших кроликов со вскрывшимися внутрь абсцессами или со множественными гнойниками в тканях, а также при острой септической форме мастита уничтожают. Шкурки после дезинфекций и высушивания используют без ограничений.
|
ПОИСК:
|
© ANIMALIALIB.RU, 2001-2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://animalialib.ru/ 'Животноводство'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://animalialib.ru/ 'Животноводство'