
Листериоз
Листериоз - инфекционная болезнь млекопитающих животных и птиц. Встречается в виде спорадических случаев, чаще энзоотически, иногда эпизоотически. Болезнь отличается многообразием форм клинического проявления. Наряду с острым септическим течением встречаются подострое и хроническое с поражением различных органов и центральной нервной системы. Установлено и скрытое переболевание листериозом.
Впервые болезнь и ее возбудителя описали в 1926 г. Murrey с сотр. В СССР листерию у кроликов выделили в 1939 г. П. П. Сахаров и Б. А. Гусев.
Этиология. Возбудитель Listeria monocytogenes принадлежит к роду Listeria, семейству Corinebacteriaceae, порядку Eubacteriales, классу Schyzomycetes. Это подвижная грамположительная палочка, спор не образует, капсулы не имеет. Характерна полиморфность микроба. Наряду с палочками длиной от 1,5 мкм до 4 и 6 мкм. встречаются мелкие кокковые формы - 0,5 - 0,6 мкм. В мазках листерии располагаются поодиночке или парами, в последнем случае они похожи на диплококки. Нередко палочки располагаются параллельно друг другу (в виде частокола) или соединяются попарно под тупым углом.
Листерии имеют пять жгутиков - один полярный и четыре по бокам. Однако подвижность бывает хорошо выражена лишь в молодых культурах, выращенных при комнатной температуре (15 - 20°). Те же штаммы листерии, инкубированные при 37°, могут не обладать подвижностью или она проявляется лишь у отдельных клеток.
Для окраски листерии по Граму также предпочтительнее делать мазки из молодых культур, выращенных при комнатной температуре, так как листерии из культур, выращенных в термостате при 37°, могут иметь иногда грамотрицательную или грамнеопределенную окраску.
Листерия - аэроб, но не строгий, так как растет и при уменьшенном содержании кислорода. Выращивают листерии при температуре 37°. Растут они и при комнатной температуре и даже при более низкой (2 - 4°), хотя рост их при этом замедляется. Диапазон рН среды, при котором наблюдается рост листерии, от 5 до 8. Оптимальным считается рН 7,0 - 7,4.
Листерия растет на обычных питательных средах, на печеночных, глюкозных, глицериновых, сывороточных, кровяных. На мясопептонном печеночном бульоне и на мясопептонном печеночном агаре с добавлением 1 % глюкозы и 2% глицерина листерии растут интенсивнее. В качестве элективных сред используют мясопептонный печеночный бульон с добавлением 0,02% теллурита калия или. 10% NaCl.
На агаре растет в виде мелких прозрачных круглых колоний. На мясопептонном бульоне вначале отмечается не очень интенсивное помутнение, при встряхивании пробирки видны так называемые муаровые полосы. Через несколько дней бульон просветляется, на дне образуется плотный осадок, при взбалтывании культуры поднимающийся в виде косички. На глюкозном бульоне осадок более рыхлый и косички не образуется.
Лакмусовое молоко обесцвечивается снизу вверх, а затем цвет восстанавливается. Восстановление цвета наблюдается и при встряхивании пробирки. Свертывания и пептонизации молока не происходит. Среда с метилротом обесцвечивается и восстановление цвета не происходит. Желатин не разжижает, пигмента, индола, аммиака, сероводорода не образует, нитраты в нитриты не переводит.
На кровяном агаре образуют зону гемолиза типа β. Гемолизируюшая способность установлена по отношению к эритроцитам кролика, овец, лошади и крупного рогатого скота.
А. А. Триполитовой (1956) не удалось обнаружить у листерий ни гиалуронидазы, ни плазмокоагулязы, ни фибролизина. Зато у них отчетливо выражена каталазная активность.
Листерий ферментируют углеводы с образованием кислоты без газа. По отношению к отдельным углеводам сахаролитическая активность у разных штаммов листерий не одинакова. Наиболее характерно быстрое сбраживание глюкозы, рамнозы, салицина, медленное сбраживание лактозы (через 3 - 5 дней) и еще медленнее сахарозы (5 - 20 дней). Остаются без изменений ман- нит, дульцит, сорбит, инозит.
Токсинообразование у листерий предполагалось многими исследователями Проводившиеся в этом направлении исследования позволили отдельным авторам выделить токсины гемолитического, некротического, летального (в опытах на мышах и куриных эмбрионах) и цитотоксического действия (на культурах клеток почки 2-дневных крольчат и эмбриона свиньи) (Р. V. Lin. J. L. Baites, 1961; К. F. Girard, A. I. Sbarra, W. A. Bardawil, 1963; O. A. Koтылев с сотр., 1966).
В старых культурах, особенно в жидких, листерий диссоциируют, образуя S-, R-, а также переходные формы. У шероховатых форм основные биологические свойства обычно сохраняются, понижается лишь вирулентность. Установлено существование R-форм и в природе. Есть сообщения, что листерий имеют фильтрующиеся формы (Г. Ф. Панин, 1957; Ф. 3. Амфитеатров и К. А. Шишкина, 1962).
При введении в организм листерии вызывают образование преципитинов. агглютининов, комплементсвязываюших антител, гемолизинов и гемагглютининов.
Листерии имеют сложную антигенную структуру Патерсон (S J Paterson. 1940) выявил у листерии пять соматических и четыре жгутиковых антигена и составил схему серологической типизации, в которой листерии разделены на четыре серологических типа. В последующие годы были обнаружены новые соматические антигены и комбинации жгутиковых антигенов В результате Н. Seeliger, G. Linzenmeir (1955) включили в схему Патерсона подтипы 4а и 4в; J. Donker Fout (1959) - подтипы la, 1в, 3а, 3в, 4ав, 4с, 4d и 4е, а И. Иванов (1962) ввел новый серотип-пятый. Однако и дополненная схема не отражала многообразия вариаций антигенной структуры у листерии, особенно в связи с существованием неустойчивых антигенов Это приводило к затруднениям при типировании штаммов листерии. Учитывая несовершенство существующей схемы, О. В. Петров (1971) разработал новую схему серологической типизации листерии и разделил их на два серотипа с одним подтипом в каждом серотипе, представляющем собой антигенную R-форму основного серотипа. Различие в антигенной структуре исследователи не связывают ни с географическим распространением листерии, ни с видом животных, от которых они выделены.
М. К. Щегловой (1959 - 1963) получен листериозный бактериофаг, но практического применения он еще не нашел.
Листерии довольно устойчивы к воздействию физических и химических факторов. При комнатной температуре фенол в 2,5%-ном растворе убивает листерии через 5 минут, лизол и креолин 5%-ный - через 10, формалин 2,5%-ный и едкий натр 2,5%-ный - через 10 - 40, 1%-ный раствор перманганата калия - через 30, риванол 1 : 500 - через 20, хлорная известь при концентрации активного хлора 100 мг в 1 л - через 60, при концентрации 200 мг - через 30 и при концентрации 400 мг - через 10 минут. 45%-ный этиловый спирт убивает листерии за 10 минут, 70 - 90%-ный - за 5 минут. Нагревание в бульоне при 100° убивает листерии за 10 минут, при 70° - за 30 минут.
Во внешней среде листерии сохраняются длительное время. При этом отмечается, что при низких температурах они сохраняются значительно дольше, чем при высоких (А. В. Селиванов, Г. А. Гриницина, 1961, и др.). Различные исследователи приводят следующие сроки сохранения листерии: в сене, соломе - до 7 месяцев, в комбикормах - 9, в овсе - до 10 месяцев, в отрубях - до года. В плохом силосе при рН 5,6 и выше листерии могут не только сохраняться длительное время, но и размножаться (В. И. Гершун, 1967). В фекалиях листерии сохраняются до 7 месяцев, в моче - до года. В воде и почве - до двух лет, а при благоприятных физико-химических условиях могут там и размножаться (Л. А. Поманская, 1962, 1963; А. А. Анагнев и Ю. Г. Ахмедов, 1970). В трупах, зарытых в землю, листерии могут сохраняться до четырех месяцев, в неконсервированных шкурах - до 90 дней (М. А. Бараненков, 1962).
В соленом мясе (баранина) при крепком посоле (21% хлористого натрия) листерии сохраняются более 20 дней. Замораживание инфицированного мяса при -10 - 23° в течение 20 дней не убивало бактерий (А. В. Селиванов, Г. А. Гриницина, 1958).
Листериоз зарегистрирован во всех частях света. В СССР он наблюдается во многих районах страны.
Эпизоотология. Листерия выделена у многих видов домашних и диких млекопитающих животных и птиц. Однако восприимчивость их не одинакова. Судя по естественной заболеваемости, из домашних животных наиболее восприимчивы овцы, козы, свиньи, крупный рогатый скот, кролики. Лошади, верблюды, собаки, кошки, пушные звери, птицы менее восприимчивы. Из лабораторных животных наиболее чувствительны белые мыши, менее - морские свинки и крысы. Весьма восприимчивой к листериозу оказалась степная пеструшка. Десять микробных тел являются для нее уже смертельной дозой (Т. Н. Дунаева, 1957).
Спонтанный листериоз у кроликов наблюдается почти исключительно среди беременных самок. У взрослых небеременных крольчих, а также у самцов болезнь не зарегистрирована. У отсаженного от матерей молодняка листериоз встречается редко. Установлено заболевание новорожденных крольчат (М. L. Gray, Ch. Singn, F. Thorp, 1955; Б. А. Гусев, 1955).
Высокая чувствительность беременных животных к листериозу отмечается у коз, овец и других видов животных, а также у человека. Это явление отчетливо выявляется при искусственном заражении кроликов, мышей, морских свинок. По данным Б. А. Гусева (1967), для подкожного и перорального заражения беременных крольчих требуется доза, в несколько сот раз меньшая, чем для не беременных крольчих. Именно в этой связи болезнь на кролиководческих фермах наблюдается, как правило, только в периоды беременности.
Листериоз может появляться во все времена года. У кроликов болезнь чаще наблюдается в весенне летнее время. Это связано с тем, что в этот период в большинстве хозяйств имеется большое количество беременных самок - животных, высокочувствительных к листериозу. В хозяйствах же, где проводятся зимние окролы, листериоз наблюдается и зимой.
Болезнь в большинстве случаев протекает энзоотически. Появившись в хозяйстве однажды, она появляется ежегодно в течение ряда лет. Известны кролиководческие хозяйства, где болезнь наблюдалась в течение 15 лет ежегодно. При этом процент поражения в равные годы колебался в крупных хозяйствах от 2 до 30, а в мелких иногда достигал 50 от основного стада. Обычно болезнь начинается в период окрола вспышкой, охватывающей значительное количество животных, а в последующие окролы болеют лишь отдельные животные. Осенью с прекращением случки самок болезнь прекращается. Однако в новом производственном году с появлением беременных животных болезнь вновь возникает.
Энзоотический характер листериоза на кролиководческих фермах при клеточном содержании кроликов, как правило, изолированных от других животных, объясняется наличием в хозяйстве постоянного резервуара инфекции. При листериозе таким резервуаром являются мышевидные грызуны. Они же являются и главным источником инфекции. Обитая на складах, кормовых кухнях, в стогах и ометах, они обсеменяют листериями корма, с которыми инфекция и заносится на ферму. Источником инфекции являются и больные листериозом кролики, которые выделяют в окружающую среду возбудителя болезни с носовым истечением, истечением из глаз, с мочой, калом, молоком; с истечением из половых органов (при абортах) и с абортированными плодами.
Поскольку листерии могут сохраняться и размножаться в силосе, в воде и почве, последние могут в отдельных случаях также являться источником инфекции. Животные в экспериментальных условиях заражаются при подкожном, внутримышечном, внутрибрюшинном и внутримозговом введении культуры листерии. Доказано заражение через рот и дыхательные пути. I. W. Osebold и Т. Inouye (1954) удалось заразить через влагалище беременных овец и кроликов. Грей с сотр. (1955), закапывая культуру листерий в глаз беременным крольчихам, вызывал у них аборт и рождение мертвых или нежизнеспособных крольчат. Этими опытами доказано и внутриутробное заражение. Имеются сообщения и о контактном заражении. Заражение через половые пути при случке не установлено. В естественных условиях наиболее вероятно заражение кроликов алиментарным путем с инфицированными кормами.
Передатчиками инфекции могут быть клещи, вши и блохи.
Патогенез изучен недостаточно. Главными воротами инфекции, через которые наиболее часто происходит заражение кроликов, следует считать пищеварительный тракт.
Распространение инфекции в организме, по мнению большинства исследователей, происходит по кровеносным и лимфатическим путям, в некоторых случаях - по нервам, по типу восходящего неврита. Попав в организм, листерий очень быстро проникают в кровь, а с нею и во внутренние органы, где их обнаруживают уже через несколько часов после заражения. Через сутки в печени обнаруживают гнездные некрозы печеночных клеток, вызванные внедрившимися в них листериями. Листерий очень быстро проникают и через плацентарный барьер. Уже через 30 - 48 часов после заражения самок у плодов в печени обнаруживались некротические очажки и выделялась чистая культура листерий (Б. А. Гусев, 1959; Грей с сотр., 1955), а у самок, павших через 3 - 4 дня после заражения, в матке обнаруживали мертвые обезвоженные плоды в виде гомогенной крошковатой массы.
Высокая чувствительность беременных самок к листериозу возможно объясняется тем, что эмбриональные ткани являются наиболее благоприятной средой для размножения листерий. Высказывается предположение, что первичной точкой инфекции самки является плод, в который листерий проникают через плапенту. Там происходит размножение их, а оттуда идет массивная реинфекция матери (Н. Flamm. 1957). Эта точка зрения подтверждается тем фактом, что самки, абортировавшие все плоды, обычно выздоравливают.
О сущности патогенетического действия листерий имеется недостаточно сведений. Существует лишь предположение, что оно обусловлено токсинами, выделяемыми микробами.
Симптоматика. Сверхострое течение болезни наблюдается в единичных случаях и чаще всего в начале вспышки листериоза. Беременные самки гибнуц внезапно в день окрола или даже в момент родов, а иногда за день-два до предполагаемой даты окрола.
Острое течение (септическое) - типичное для] листериоза кроликов. Как правило, без предварительных симптомов, а иногда после кратковременного угнетения у самки, находящейся во второй половине беременности, наступает аборт. При этом самки абортируют не все плоды, а только часть их. Остальные остаются в матке, что легко установить прощупыванием. После аборта животное угнетено, отказывается от корма. Волосяной покров теряет блеск, становится взъерошенным, животное худеет. Из влагалища выделяются кровянистые или грязно-коричневые истечения, в связи с чем волосяной покров в области огузка мокрый и испачкан выделениями. Болезнь продолжается 2 - 4 дня и почти всегда заканчивается гибелью животного. Иногда у больных самок появляются параличи преимущественно задних конечностей.
Отдельные самки через 4 - 5 дней после аборта начинают поедать корм, угнетение постепенно исчезает, однако животные остаются малоподвижными и не восстанавливают упитанность. При прощупывании брюшной полости обнаруживается матка с оставшимися в ней плодами в виде твердых бугристых тяжей. Такие самки через три-четыре недели также обычно погибают.
В некоторых случаях острого течения болезни у самок во второй половине беременности появляются признаки сильного угнетения, они полностью отказываются от корма. Животные болеют 2 - 4 дня и погибают, не абортируя.
Подострое и хроническое течение болезни встречается довольно редко. Оно обычно не сопровождается абортом. За несколько дней до окрола у самок появляются признаки угнетения, они становятся малоподвижными, полностью или частично отказываются от корма. В предполагаемый срок роды не наступают. При прощупывании матка ощущается в виде твердого малоподвижного тела величиной с куриное яйцо и больше. Объясняется это тем, что произошло рассасывание околоплодной жидкости, плоды омертвели и подвергаются распаду. Матка воспалена и вследствие слипчивого воспаления периметрия собрана в комок. Большинство таких самок погибает на 10 - 14-й день заболевания, некоторые же гибнут через 1 - 2 месяца. У единичных самок через 5 - 6 дней восстанавливается аппетит, и они выживают. Находившиеся в матке плоды постепенно рассасываются, однако такие самки в дальнейшем не дают приплода. Являясь опасным источником инфекции, они подлежат уничтожению.
Атипичное течение болезни характеризуется следующими признаками. Без каких-либо предвестников болезни самки абортируют полностью все плоды. После аборта у них удается наблюдать лишь легкое угнетение и слабый позыв к корму в течение 1 - 2 дней, после чего наступает выздоровление. В других случаях здоровые на вид самки вынашивают плоды и родят в срок, но либо мертвых, либо живых нормально развитых крольчат, погибающих в первые шесть дней после рождения. Признаков болезни у самок обычно при этом не отмечается. Лишь в отдельных случаях, когда плацента не отделяется и остается в матке, у самок на другой день после окрола или полного аборта появляются признаки нарастающего угнетения, а через сутки или двое животные гибнут.
Скрытое течение болезни характеризуется гибелью плодов на ранней стадии развития с последующим рассасыванием их. При этом., не удается заметить каких-либо признаков переболевания животного. Кролиководы лишь констатируют, что установленная при прощупывании на 10 - 14-й день после случки беременность исчезает, повышается процент прохолостания самок.
Листериоз у новорожденных крольчат наблюдается в период массовых вспышек этой болезни. Поражается молодняк лишь в отдельных гнездах. Крольчата заражаются внутриутробно и гибнут в первые шесть дней после рождения. Как правило, гибнет весь помет сразу, реже постепенно, в течение нескольких дней. Клинических симптомов обычно заметить не удается, крольчат находят уже мертвыми, разбросанными по клетке. В тех случаях, когда крольчата погибают не сразу, у них удается заметить конвульсивные движения, запрокидывание головы, плавательные движения конечностей. Крольчата обычно не лежат в гнезде, а ползают по клетке.
В более позднем возрасте листериоз у молодняка регистрируется редко. Болезнь может проявляться в виде внезапного падежа без каких-либо предварительных симптомов заболевания. Наиболее же характерно кратковременное переболевание. При этом отмечается угнетение, сонливость, снижение и потеря аппетита, истощение, понос. Как правило, через 1 - 6 дней болезнь оканчивается смертью животного. Перед смертью у больного наступает сильная слабость, животное лежит на боку, не реагируя на окружающее. Смерть наступает после непродолжительных судорог.
Наряду с острым течением болезни в виде спорадических случаев наблюдается подострое и хроническое течение с признаками нарушения центральной нервной системы. У больных наблюдаются парезы, а затем и параличи конечностей или кривоголовость. Больные животные постепенно худеют и гибнут от истощения.
В отличие от крупных животных у кроликов при листериозе наблюдается увеличение количества моноцитов в крови, достигающее на 3 - 4-й день болезни 20% и более по отношению к общему количеству лейкоцитов.
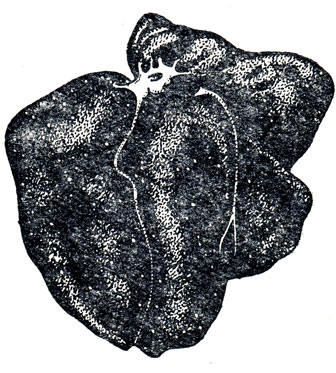
Рис. 6. Листериоз. Некротические узелки в печени
Патологоанатомические изменения. У молодняка при остром течении листериоза наблюдаются характерные изменения в печени, выражающиеся в мелкоточечных узелках некроза печеночной ткани. Эти узелки белого цвета, густо рассеяны по всей поверхности печени (рис. 6). Часто такие же узелки обнаруживаются в селезенке. Последняя обычно увеличена, темно-красного цвета, пульпа ее черно-красная, размягчена или полужидкой консистенции. Сравнительно редко некротические поражения в виде точек или несколько большего размера встречаются в мышце сердца. Лимфатические узлы, особенно мезентериальные, увеличены, серо-красного цвета В других органах изменения либо непостоянны, либо макроскопически не обнаруживаются
В подострых и хронических случаях, протекающих с менинго энцефалитическими явлениями, макроскопических изменений в органах грудной и брюшной полости не обнаруживается. При вскрытии черепа отмечается кровенаполнение сосудов.
У мертворожденных крольчат и павших в первые дни рождения макроскопически изменения обнаружить трудно. Наблюдается лишь сильное кровенаполнение печени и в редких случаях обнаруживают белые или желтоватые участки некроза печеночной ткани.
У взрослых самок печень увеличена, дрябловатая, часто окрашена в светло-коричневый цвет, нередко имеет мускатность. Некротические поражения имеют вид точек или светло-коричневых, а иногда бледно-желтых и белых диффузных пятен площадью до 3 - 4 см2.
Селезенка припухшая, темно-красного цвета, пульпа ее размягчена, темно- или черно-красного цвета. Под капсулой нередко можно обнаружить белые мелкоточечные очаги некроза. Лимфатические узлы увеличены, серо-красного цвета.
Сильные изменения находят в матке. Эти изменения, сводящиеся в основном к метриту, расплавлению и рассасыванию плодов, имеют неодинаковую картину, что зависит от срока течения болезни. Лишь при сверхострой форме в матке, находящейся в предродовом состоянии, можно не обнаружить патологических изменений. Однако у нормальных по развитию плодов можно заметить начавшуюся мацерацию поверхностного слоя кожи.
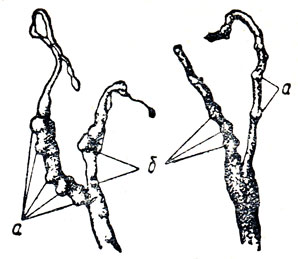
Рис. 7. Матки с зародышами (а, б), погибшими на ранней стадии развития при скрытом течении листериоза
У абортировавших самок при остром течении, как правило, в матке находятся несколько оставшихся плодов. Причем только в очень острых случаях плоды сохраняют нормальный внешний вид. Обычно же они представляют собой обезвоженную, бесформенную творожистую массу розоватого или сероватого цвета. В просвете матки находится грязно-коричневого или красно-коричневого цвета жидкость. Стенка матки утолщена, слизистая набухшая, гиперемирована. Снаружи матка красного или темно-красного цвета. При более продолжительном переболевании поражения выражены еще сильнее. Матка снаружи имеет полосатый вид, красные участки чередуются с белыми или кремовыми участками омертвения стенки матки. Перитонеальная оболочка воспалена, покрыта пленками фибрина; вследствие слипчивого воспаления матка собрана в плотный комок. Воспалительный процесс может распространяться и на перитонеальную оболочку прилегающих к матке петель кишок. В просвете матки творожистая гнойная масса.
У самок при хроническом течении болезни в матке обнаруживают местные флуктуирующие утолщения, содержащие мутную гнойную жидкость с белыми пленками омертвевшей ткани плода и слизистой матки.
При атипичном течении болезни у самок, абортировавших полностью все плоды, обратное развитие матки несколько задерживается. В течение первой недели стенка матки утолщена, в просвете сохраняется небольшое количество белой творожистой массы. К концу месяца матка почти приходит в норму, однако стенки ее все еще остаются несколько утолщенными, а в просвете сохраняется мутная, слизистая, желтоватого цвета жидкость.
При скрытом течении в матке отлично видны следы многоплодной беременности. На месте прикрепления плодов обнаруживаются утолщения в виде отграниченных узлов красного или белого цвета величиной от 3 до 10 мм и более, с творожистым или гнойным содержимым (рис. 7).
Гистологические исследования, проведенные Г. В. Борисовой (1959), показали, что в образовании характерных для листериоза некротических узлов во внутренних органах можно различить следующие стадии. В печени, например, вначале вследствие инвазии листериями печеночных клеток появляются гнездные некрозы. Затем вокруг них замечается скопление лейкоцитов и лимфоидных клеток, происходит образование гранулем. От центра к периферии гранулемы идет постепенный некроз печеночных клеток и одновременно наблюдаются признаки экссудации - отложение сеточки фибрина. Далее в периферических отделах гранулемы появляются эпителиоидные клетки и фиброциты; количество их постепенно увеличивается В случаях более длительного течения болезни удавалось проследить рубцевание и втяжение капсулы Наблюдалось образование фокусов соединительной ткани в виде мелких рубчиков, невидимых на вскрытии. Кроме описанных изменений, отмечались явления белковой и жировой дистрофии.
Изменения в селезенке характеризовались гиперплазией фолликулов, набуханием ретикулярных клеток, обширными некрозами, захватывающими фолликулы и распространяющимися на красную пульпу В лимфоузлах не всегда находили увеличение фолликулов, набухание ретикулярных клеток и очаги некрозов преимущественно в фолликулах. В других органах изменения встречались редко. В желудочно-кишечном тракте изменений не отмечалось.
Диагноз и дифференциальный диагноз. Диагностировать листериоз у взрослых кроликов не представляет больших трудностей. Клинические и патологоанатомические признаки характерны. Характерно и то, что болезнь и отход наблюдаются только среди беременных самок. Листериоз у молодняка клинически трудно отличить от острого течения кокцидиоза, пастереллеза и гастроэнтерита. Но характерные поражения печени, а тем более селезенки, обнаруживаемые при вскрытии, позволяют легко дифференцировать болезнь и у молодняка.
Наблюдаемые при печеночной форме кокцидиоза поражения печени отличаются от таковых при листериозе. При кокцидиозе они выступают на поверхности печени в виде белых или желтоватых узлов и тяжей разной величины, окруженных соединительнотканой капсулой, и представляют собой расширенные и утолщенные желчные ходы. При разрезе из них вытекает слизистое или крошковатое содержимое. При листериозе поражаются паренхиматозные клетки печени, соединительнотканые разращения вокруг некротических очажков отсутствуют. Кроме того, при кокцидиозе отсутствуют характерные для листериоза изменения селезенки.
Окончательный диагноз устанавливают лабораторным исследованием патологического материала. Для бактериологического исследования направляют целиком свежий труп кролика. В случае пересылки на дальнее расстояние направляют сердце, печень, селезенку, а от взрослых обязательно и матку с ее содержимым (или часть ее). При хроническом течении листериоза с выраженными явлениями менингита посылают мозг. Органы помещают в 30 - 35%-ный раствор глицерина или в 20%-ный раствор поваренной соли.
Чистые культуры листерий из патологического материала от кроликов обычно удается получить уже из первичных высевов из сердца, матки, печени, а также селезенки при наличии в ней патологических изменений. Посевы из мозга делают лишь при наличии у больных признаков заболевания центральной нервной системы. Посевы рекомендуется делать множественными, в несколько пробирок из каждого органа. Предпочтительнее использовать для посевов суспензии из вышеуказанных органов.
Наряду с посевами на питательные среды рекомендуется одновременно заражать белых мышей суспензией из патологического материала.
При получении чистой культуры листерий идентификацию их проводят на основании комплекса морфологических, тинкториальных, культуральных, биохимических и серологических свойств, а также глазной пробы. Глазную пробу ставят путем закапывания двух капель чистой культуры на конъюнктиву глаза морской свинки (предпочтительнее) или кролика. Культура листерий через 2 - 3 дня вызывает гнойный конъюнктивит.
Патогенность культуры проверяется на белых мышах. В целях большой эффективности заражения рекомендуется ставить опыт на мышах весом не более 18 г. За 3 - 4 часа до заражения им вводят внутримышечно 5 мг кортизона (ацетат кортизона). Культуру листерий вводят под кожу в дозе 0,5 мл. Эффективным оказалось заражение белых мышей-сосунков 7 - 8-дневного возраста (Ф. С. Шуляк, 1964). Введение под кожу в области спины 0,2 мл культуры листерий вызывает их гибель через 18 - 36 часов. При использовании кроликов их заражают интравенозно в дозе 0,5 - 1,0 мл суточной бульонной культуры. Для серологической идентификации листерий используют поливалентную листериозную агглютинирующую сыворотку в капельной реакции на стекле со смывом испытуемой агаровой культуры. Принадлежность идентифицированных культур к тому или иному серотипу определяют также капельной реакцией с типовыми агглютинирующими сыворотками первого и второго серотипов (серогрупп).
Лечение. Для лечения больных животных применялось большое количество химиотерапевтических средств и антибиотиков: миарсенол, сульфантрол, сульфапиридин, сульфаниламид, пронтозил, неопронтозил, фуразолидон, пенициллин, зкмоновоциллин, левомицетин, церин, эритромицин, террамииин, биомицин. Лучшим из них оказался биомицин. Однако возможность применения его при листериозе кроликов весьма ограниченна. Поскольку листериозом болеют преимущественно беременные крольчихи и клинические симптомы у них появляются после того, как плоды уже погибли, лечить их не имеет смысла, так как наряду с освобождением организма от листерий для излечения животного необходимо изгнать мертвые плоды из матки, а это практически неосуществимо.
Для лечения небеременных крольчих, молодняка, а также самок с атипичным течением листериоза рекомендуется в самом начале болезни применять биомицин в дозе 20 мг на 1 кг веса кролика в течение трех дней подряд. Биомицин задают через рот (или вводят внутримышечно) один раз в день (или два раза по 10 мг/кг). Следует иметь в виду, что часть кроликов, выздоровевших после лечения, остается листерионосителями, поэтому животных, подвергавшихся лечению, не рекомендуется оставлять на племя. Необходимо также помнить, что биомицин может оказывать токсическое действие на организм кролика, поэтому его следует применять не более трех дней, не превышая указанной дозы.
Меры борьбы и профилактика. Предложенные средства специфической профилактики листериоза пока еще не апробированы. В целях борьбы с листериозом проводят общие профилактические и противоэпизоотические мероприятия, а также ряд дополнительных мер.
В каждом кролиководческом хозяйстве систематически ведут борьбу с грызунами. В крупных хозяйствах целесообразно в этих целях заключить договор с дератизационным отрядом. Принимаются меры к недопущению доступа грызунов к кормам на складе и кормокухне. Проверяют скирды соломы и сена на заселенность их грызунами и в случае заселения проводят дератизацию. В неблагополучном хозяйстве беременным самкам концентрированные корма скармливают после их пропаривания. Сено и солому скармливают из скирд и ометов, не заселенных грызунами. При отсутствии таковых используют лишь верхние 2/3 скирды, так как они менее заселены грызунами. Силос скармливают только исключительно доброкачественный с рН не выше 5,5.
Очень важно своевременно удалять из стада всех больных и, поскольку лечение их нецелесообразно, убивать их. Мясо больного листериозом животного разрешается выпускать из хозяйства только после 2-часовой проварки на месте убоя. Шкурки выпускают из хозяйства лишь после специальной дезинфекции. Для дезинфекции употребляют раствор смеси, в которую входят сульфанол - 0,3%, алюминиевые квасцы - 2%, кремнефтористый натрий - 0,2% и хлористый натрий - 26%. Указанные средства растворяют в воде в порядке их перечисления. Количество раствора должно превышать вес дезинфицируемых шкурок в пять раз. В дезинфицирующем растворе шкурки выдерживают 20 часов, а затем на 24 часа оставляют вне раствора (М. А. Бараненков. 1962). При отсутствии в хозяйстве условий для такого выпуска мяса и шкурок их уничтожают.
Трупы животных и абортированные плоды сжигают или зарывают в землю. Навоз из зараженных клеток сжигают или с предосторожностями, не допускающими рассеивания инфекции, вывозят для биотермического обезвреживания в течение 2 - 3 месяцев.
Для дезинфекции помещений и предметов ухода применяют 3%-ный горячий раствор едкого натрия, 5%-ную горячую эмульсию ксилонафта или 6%-ную эмульсию дезинфекционного креолина.
Для аэрозольной дезинфекции применяют 20%-ный раствор формальдегида из расчета 20 мл на 1 м3 при экспозиции 4 часа или формалин-креолиновую (ксилонафтовую) смесь: 3 части продажного формалина и одна часть 50%-ной водной эмульсии креолина (ксилонафта) из расчета 15 мл на 1 м3 с экспозицией 4 часа.
Принимают меры к устранению недостатков кормления и содержания, способствующих ослаблению организма кроликов. Обслуживающий персонал должен строго соблюдать правила личной гигиены. Хозяйство, где становлен листериоз, объявляется неблагополучным, рок карантина два месяца.
|
ПОИСК:
|
© ANIMALIALIB.RU, 2001-2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://animalialib.ru/ 'Животноводство'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://animalialib.ru/ 'Животноводство'