
Бруцеллёз крупного рогатого скота
Патогенез. Проникнув в организм крупного рогатого скота per os, инфекционный агент обнаруживается уже через 6 дней в лимфатических узлах пищеварительного тракта; на 11-й день после инфекции начинается генерализация процесса, которая достигает через 21 день своего максимума. В этот момент бациллы бруцеллёза обнаруживаются не только в лимфатических узлах пищеварительного тракта, но и в печени, в селезёнке, в лимфатических узлах туловища, в вымени и в надвыменных железах. По истечении 49 дней после искусственного заражения инфекция явно спадает (ограничивается в размерах).
У тёлки, убитой на 90-й день после заражения, исследователи обнаружили возбудителя лишь в одной лимфатической подчелюстной железе и в вымени. У четырёх из пяти инфицированных тёлок бацилла бруцеллёза была найдена в вымени более чем через месяц после начала опыта. В небеременной матке ни разу не оказалось бацилл бруцеллёза. Инфекция не сопровождалась ни подъёмом температуры, ни какими-либо симптомами.
Из 25 коров бруцеллёзного стада, никогда не абортировавших, только 6 показали кратковременную реакцию на абортин и по агглютинации крови и молочной сыворотки в первый месяц после отёла. У двух из этих коров установлено в молоке присутствие br. abortus. Таким образом, 19 коров оказались иммунными (естественно или после переболеваиия).
Развитие бруцеллёза у телят в возрасте от 15 дней до 6 месяцев зависит от способа заражения, вероятно, от массивности его, а также, очевидно, от индивидуальной устойчивости. Телята, заражённые в кожу, раньше всех обнаружили положительную реакцию агглютинации и удержали её, хотя и в низком титре, до половозрелого возраста. Один телёнок из этой группы оказался бацилловыделителем (в моче обнаружена br. abortus). Группа телят, заражённых per os и через конъюнктиву, стала реагировать по агглютинации позже и к полугодовалому возрасту утратила агглютинационный титр. Ни у одного из этих телят бацилловыделения не обнаружено.
Молодняк оказывается сравнительно устойчивым к бруцеллёзу, за исключением случаев массивного кожного заражения. Бациллы Банга удавалось обнаружить в вымени молодых тёлок до лактации.
Беременная матка особенно предрасположена к внедрению и фиксации бактерий бруцеллёза. Второе по восприимчивости место - вымя. Проникновение инфекционного агента происходит, видимо, главным образом, по кровеносной системе.
Бациллы бруцеллёза, кроме длительного пребывания в беременной матке, откуда они исчезают вскоре после выкидыша (максимум через 51 день), а также в вымени, задерживаются и в лимфатических узлах, иногда в воспалённых сухожильных влагалищах и слизистых сумках. В исключительно редких случаях инфекционное начало находили в печени, в мышцах диафрагмы.
При вскрытии на бойне 225 коров и 11 быков, выбракованных из бруцеллёзных хозяйств, были обнаружены следующие процессы: а) бурситы, артриты и анкилозы различных суставов конечностей (у 5% животных); б) хронические метриты (у 24%); в) оофориты и кистозные перерождения яичников (у 12,4%); г) сальпингиты серозные и серознофибринозные (у 4,9%); абсцессы в печени (у 15,1%).
Бактериологическими посевами на среды и заражением морских свинок чистые культуры бруцеллёза были выделены у 51% животных.
Бруцеллёз крупного рогатого скота не всегда протекает бессимптомно; при ослаблении организма, в результате плохого содержания и побочных болезней, он может развиться в тяжёлое общее заболевание с резкими клиническими явлениями, а иногда и с летальным исходом. В большинстве случаев абортируют животные, заразившиеся в период беременности, и не абортируют получившие инфекцию до случки. Чем больше инфицирующая доза заразного начала, тем короче инкубационный период и вернее происходит заболевание.
Инкубационный период. Между моментом заражения и абортом (как первым клиническим признаком инфекции) может пройти 33 - 230 дней. Однако новейшие исследования показали, что возбудитель инфекции может быть обнаружен уже на 7-й день после искусственного заражения в мезентериальных лимфатических узлах, а через 21 день - и в паренхиматозных органах, в вымени, в лимфатических узлах туловища.
Длительность инкубационного периода тесно связана с периодом беременности, в котором произошло заражение. В естественных условиях аборты наиболее часты на 5 - 7-м месяце стельности. Заражение, происшедшее не в период беременности, обычно не ведёт к аборту.
Клиническая картина. У крупного рогатого скота бруцеллёз преимущественно протекает как латентная инфекция, не сопровождающаяся лихорадкой. Бросающимся в глаза признаком являются множественные аборты в стаде; за ними следуют множественные задержания последа и метриты.
Однако сам по себе аборт - не обязательный признак инфекции; с одной стороны, он может вызываться другими причинами, с другой - не все инфицированные коровы абортируют. Кроме того, скинувшее животное обычно остаётся надолго носителем инфекции, а аборт, за редкими исключениями, не повторяется.
Аборту, как и нормальным родам, предшествуют набухание и покраснение срамных губ и слизистой вагины, буровато- или красновато-жёлтое, без запаха, слизистое, иногда стекловидное истечение из влагалища, а также набухание вымени и уменьшение отделения молока, приобретающего цвет и свойства колострального. Эти явления, не всегда резко выраженные, появляются обычно за несколько дней до выкидыша.
Кроме перечисленных явлений, клиническими признаками считаются бурситы, гигромы и абсцессы. Абсцессы располагаются преимущественно на задних, а бурситы и гигромы - главным образом, на передних конечностях. У поражённых быков довольно редко констатируют орхит, а также опухание придатка яичка. Характерной клинической картины при бруцеллёзе крупного рогатого скота обычно не наблюдается. Выше уже отмечены изредка обнаруживаемые поражения половых органов, суставов, лимфатических узлов.
После выкидыша у значительного процента животных отмечаются задержание последа и метриты, сопровождающиеся грязновато-бурым или красноватым истечением из матки, иногда с вонючим запахом.
Наблюдения показывают, что коровы после инфекционного выкидыша приобретают иммунитет к аборту и вторичные выкидыши у них наблюдаются редко. Однако в виде исключения бывают не только повторные выкидыши, но даже и такие случаи, когда одно и то же животное абортирует три раза. Множественность выкидышей в заражённых хозяйствах варьирует от единичных случаев до абортов у 50% и даже у 90% всех наличных коров. Такие различия объясняются колебаниями вирулентности возбудителя, а также и изменчивой устойчивостью данного стада.
К числу клинических явлений бруцеллёза у коров следует отнести изменения в вымени. Выделение бруцелл с молоком у поражённых животных - явление довольно частое, но оно не сопровождается обычно какими-нибудь ясно заметными признаками. Отмечают скоропроходящую болезненность в задней четверти вымени после искусственного заражения стельных животных; меняется состав молока: происходит уменьшение молочного сахара и увеличение количества хлора, каталазы и клеточных элементов. Присутствие бруцелл в вымени стимулирует, повидимому, иногда и развитие маститов (когда в соответствующие части вымени проникают другие, подлинные возбудители маститов).
Течение. При описании естественного заражения мы уже указывали, что инфекция не всегда влечёт за собой изгнание мёртвого плода; иногда рождается хилый телёнок, быстро гибнущий. При заражении в позднем периоде стельности плод донашивается и может оказаться жизнеспособным. Чаще всего аборт наблюдается на 7-м месяце беременности, но бывают и ранние случаи - на 3 - 4-м месяце, а также поздние - на 8 - 9-м месяце. Тут, очевидно, играют роль и момент инфекции и вирулентность возбудителя, а также индивидуальная восприимчивость данного животного. В некоторых случаях происходит смерть и мумификация плода в матке.
Течение бруцеллёза крупного рогатого скота хроническое. Аборты со скоро проходящими или затягивающимися метритами вызывают у значительного числа коров длительное бесплодие. Однако большинство животных через 2 месяца вновь способно к зачатию. В начале развития инфекции в стаде регистрируются единичные аборты; позже число их нарастает; в дальнейшем, если в хозяйство не поступает животных со стороны, аборты прекращаются, инфекция затухает. Она может окончательно самоликвидироваться, причём возбудитель или погибает, или переходит в авирулентное состояние.
Патолого-анатомические изменения. Плодные оболочки студенисто инфильтрированы (с желтоватым оттенком) и местами покрыты хлопьями фибрина и гноя, иногда утолщены и пронизаны кровоизлияниями. В желудке и особенно в сычуге плода обнаруживают желтоватые или белые слизистые и хлопчатые массы. Под серозными оболочками, на слизистой оболочке желудочно-кишечного тракта и мочевого пузыря нередки точечные и полосчатые геморрагии. В серозных полостях, наряду со свёртками фибрина, может находиться красноватая жидкость. Подкожная и межмускульная соединительная ткань может быть пропитана серозно-кровянистым содержимым. Набухание лимфатических узлов и увеличение селезёнки, с наличием воспалительно-некротических очажков, также относятся к числу бруцеллёзных изменений.
У новорождённых животных и абортированных плодов отмечают очаговые пневмонии; пуповина часто серозно инфильтрирована; некоторые телята рождаются покрытыми гнойным экссудатом. У стельных коров между слизистой оболочкой матки и хорионом цаходят серовато-грязный экссудат с хлопьями гноя; на котиледонах местами также обнаруживают изменения, подобные находимым на околоплодных оболочках. В вымени - в паренхиме, интерстиции и выводных протоках - микроскопически устанавливаются небольшие воспалённые очаги.
У быков отмечаются в семенных пузырьках кровоизлияния, а также некротические очаги; в testes и придатках - воспалительно-некротические и гнойные очаги величиной с лесной орех; иногда омертвевает весь семенник, превращающийся в желтоватую гомогенную массу, которая заложена в саушп vaginale, наполненном серозно-гнойным экссудатом. В хронических случаях поражённые семенники с придатками, вследствие разрастания соединительной ткани, могут достигать величины головы ребёнка.
В беременной матке бациллы поселяются, главным образом, в эпителиальной ткани хориона, вызывают гнойное воспаление с поверхностным некрозом покровного эпителия ресничек хориона, а также образование гнойно-фибринозного экссудата между последним и слизистой матки.
В результате воспаления и некротического распада связей между плодовой и материнской плацентами нарушается питание зародыша, и он погибает и выталкивается наружу или мумифицируется. Очень часто под влиянием того же воспалительного процесса происходит спайка яйцевых оболочек плода с материнской плацентой, в результате чего наступает задержание последа, а также метрит на почве проникновения различных других микробов. У бруцеллёзных быков палочки Ванга оседают (в небольшом проценте случаев) в семенных железах, придатках яичек, в семяпроводах, а также в прилежащих лимфатических узлах, что сопровождается набуханием мошонки, абсцессами и некрозами этих поражённых отделов.
Диагноз. Клинические симптомы бруцеллёза крупного рогатого скота, так же как и патолого-анатомические данные, представляют слишком слабую опору для установления диагноза. Множественные аборты, задержания последов, орхиты быков - всё это может давать лишь повод подозревать бруцеллёз. Поэтому диагностика бруцеллёза базировалась до сих пор на бактериологическом и серологическом исследованиях; в 1935 - 1939 гг. нашёл применение аллергический метод диагностики.
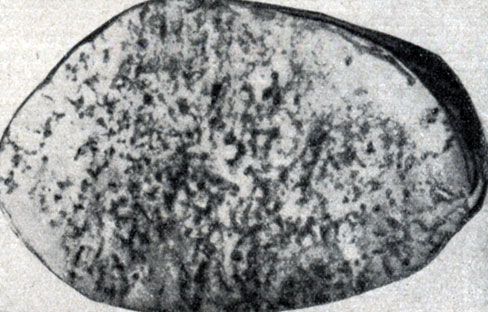
Рис. 50. Бруцеллёз у быка: воспалительно-некротические очаги на поверхности разреза семенника
Для бактериологической диагностики посылают в лабораторию (с соблюдением требуемых предосторожностей против рассеивания заразы) следующие материалы: абортированный плод целиком или перевязанный желудок его с содержимым, куски поражённых яйцевых оболочек с котиледонами; при отсутствии этих материалов - маточное истечение скинувшего животного, собранное в стерильную посуду, наконец - пробы молока и крови.
Для выделения чистой культуры бруцеллёза существует несколько способов, частично уже указанных нами выше. Лучшим из них для культивирования группы brucella из патологических материалов (содержимое желудка плода, яйцевые оболочки и пр.) считается метод, предложенный Хеддльсоном.
Свежую печень рогатого скота перемалывают на мясорубке. 500,0 полученной массы и 500 мл дестиллированной воды помещают в кастрюлю, хорошо смешивают и затем оставляют в холодном помещении на 24 часа. Затем кастрюлю закрывают и ставят на 20 минут в текучий пар. По истечении указанного срока сдвигают крышку и помешивают стеклянной палочкой так, чтобы всё содержимое нагревалось равномерно. Нагревание в текучем паре продолжается 11/2 часа. Смесь фильтруется через проволочное сито. Приготовленный таким образом настой служит для получения плотной среды или бульонного настоя. Настой не рекомендуется стерилизовать и переделывать в среду для позднейшего культивирования. Последующие стерилизации существенно ослабляют факторы настоя, стимулирующие рост. Главные факторы в печёночном настое, стимулирующие рост, - соединения серы, разлагаемые нагреванием.
Чтобы приготовить один литр печёночного агара, необходимы следующие ингредиенты:
Промытого агара 20,0
Дестиллированной воды 500 мл
Печёночного настоя 500 "
Пептона (Bacto) 5,0
Химически чистого хлористого натрия 5,0
Все ингредиенты помещают в соответствующую закрытую посуду, ставят в текучий пар на 1 час и затем остуживают до 60°С, pH в это время доводится до 7,2. Во время стерилизации pH снижается обычно до 6,6 - 6,8, что составляет оптимум для роста бруцелл. После этого посуду со средой снова помещают в текучий пар на 11/2 часа. Содержимое декантируют, разливают в стерильные флаконы или пробирки и стерилизуют 30 минут под давлением 1,5 атмосферы.
Заключительная среда, приготовленная в соответствии с описанным методом, обычно не прозрачна, но это не должно служить препятствием к её использованию. Финальный продукт может быть освобождён от осадка и взвешенных частиц, если его пропустить перед стерилизацией через быструю центрифугу.
Описанную среду, после засева нескольких чашек Петри содержимым желудка плода или эмульсией, приготовленной на физиологическом растворе поваренной соли из поражённых участков яйцевых оболочек, ставят на 15 часов в термостат, а затем переносят в экссикатор, в котором 10% воздуха замешено CO2, и выдерживают в термостате 3 - 5 и больше дней. Самый упрощённый метод создания 10% содержания углекислоты в экссикаторе - сжигание в нём нескольких капель спирта; по окончании горения плотно закрывают пришлифованную и смазанную вазелином крышку экссикатора.
Описанный метод применяют, главным образом, для культивирования бацилл бруцеллёза из молока, чтобы определить содержание в нём инфекционного начала и, следовательно, опасность рассеивания заразы соответствующим животным. Молоко надо употреблять совершенно свежее, и для засевов из него рекомендуют брать смесь отцентрифугированного осадка сливок и цельного, предварительно встряхнутого молока. Опыт показал, что бациллы бруцеллёза могут содержаться в одной четверти вымени и отсутствовать в другой; поэтому необходимо исследовать пробы молока, выдоенные отдельно из каждого соска. Выделение на чашке Петри прозрачных, как капельки росы, очень мелких колоний бруцеллёза с фиолетовым оттенком не представляет для опытного глаза особых трудностей. Однако для этого нужно наметать глаз и ознакомиться со структурой колоний.
Выделенные и пересеянные в пробирки культуры бруцеллёза идентифицируются посредством специфической агглютинирующей сыворотки.
Более надёжным методом бактериологической диагностики бруцеллёза служит заражение морских свинок.
Испытуемый материал вводят подкожно в небольшом количестве (0,1 - 0,3 мл). Развитие процесса у морской свинки идёт медленно, и убой её можно производить лишь через 35 - 56 дней после заражения, что чрезвычайно затягивает диагноз. Поэтому рекомендуют раннее исследование крови морских свинок реакцией агглютинации. В положительных случаях в крови больных свинок уже на 10-й день после заражения, иногда и раньше, отмечается появление агглютининов. Нормальный агглютинационный титр сыворотки морской свинки ниже разведения 1:5, поэтому положительной реакцией считается агглютинация в разведении 1:5 - 1:10 и выше.
Исследовать кровь морской свинки начинают с 8-го дня и продолжают до 56-го дня, так как не всегда наблюдается быстрое появление агглютининов. При отсутствии у свинки реакции агглютинации нельзя надеяться и на получение культуры. После убоя заражённой свинки культуры бруцеллёза выделяют посевами из селезёнки, костного мозга и лимфатических узлов.
Реакция агглютинации Райта (РА) получила широкое применение в диагностике бруцеллёза, так как инфекция имеет среди животных массовое распространение, а проводить массовые бактериологические анализы немыслимо, да они были бы и бесцельны. Выделение возбудителя из крови животных удаётся лишь в редких случацх, а исследование молока или истечения из половых органов громоздко и тоже далеко не всегда приводит к цели. Между тем постановка РА с кровью относительно легка и доступна, по крайней мере для ориентировочной массовой диагностики.
Основными предпосылками для практического применения метода агглютинации должны служить единство методики приготовления антигена для реакции, оценки реакции и использования сывороток для исследования.
Приготовление антигена должно быть стандартным. Прежде всего требуется выбор штамма или нескольких штаммов бруцеллёза, хорошо агглютинирующихся положительными сыворотками различных титров и не дающих спонтанной агглютинации с сыворотками нормальными или с физиологическим раствором поваренной соли. Концентрация (густота эмульсии) антигена также должна быть постоянной. В отношении сыворотки необходимо установить разведение, например, 1:50, чтобы считать его положительным или сомнительным результатом. Более высокие разведения оценивают как безусловно положительные. В разведении же 1:50 сыворотка проверяется вторично через двухнедельный срок, и при повторном совпадающем результате признаётся положительной.
Опыт показал, что не все бруцеллёзные животные дают положительную реакцию агглютинации и даже, более того, коровы, выделяющие с молоком бациллы бруцеллёза, иногда не реагируют (5 - 10%). Титр сывороток подвержен известным колебаниям; нереагирующие животные иногда абортируют, а дающие положительную реакцию иногда телятся нормально на протяжении всей жизни. Всё это смущает практиков. Однако все положительные случаи реакции агглютинации (за исключением случаев технических ошибок, допущенных при постановке этой реакции в лаборатории, неправильной оценки показаний загрязнённых и испытуемых сывороток и нередкого перепутывания номеров животных) определённо говорят о наличии бруцеллёза у исследуемого животного.
Недостатком реакции агглютинации признают также необходимость частых кровопусканий у животных, что создаёт почти непреодолимые трудности при реализации этого метода в крупных хозяйствах, в особенности у овец и свиней. У последних неудобство усугубляется тем, что изъятие крови производят из хвоста.
Недостатки реакции агглютинации как диагностического метода были особенно рельефно охарактеризованы работой, выполненной по поручению Международного эпизоотического бюро, по сравнению антигенов, методов постановки РА, а также читки: и оценки реакций в разных странах, в лабораториях, руководимых выдающимися исследователями.
Для сравнительного испытания были использованы 50 сывороток от животных бруцеллёзного хозяйства.
Все сыворотки были испытаны с разными антигенами и по разной методике, в соответствии с описаниями последней, данными представителями ветеринарной науки в разных странах. Результат получился следующий.

Эта таблица совершенно ясно показывает, как сильно варьируют результаты реакции Райта в зависимости от концентрации антигенов (бактерийных суспензий), методики постановки и чтения реакции. Совершенно очевидно, что и антиген и методика должны быть едиными не только в одной стране, но и в разных государствах, преследующих цель искоренения бруцеллёза.
В УССР Жованик и др. изучали колебания титра реакции агглютинации у бруцеллёзных коров на протяжении 11 месяцев, исследуя кровь один раз в месяц у всех испытуемых животных.
В трёх бруцеллёзных хозяйствах положительно реагировали на протяжении всего периода исследования 35,5% из 575 исследованных животных, сомнительную реакцию давали 32,2%, а у 32,3% животных РА была отрицательной. Из группы положительно реагировавших животных только 43,3% коров неизменно давали положительный результат, а у остальных наблюдалось выпадение реакции (21,2% коров) или же титр агглютинации снижался до 1:50 (35,5%). В группе сомнительно реагировавших животных процент утративших реакцию был значительнее (35,1), а процент снизивших реакцию до титра 1:25 составлял 34.
Длительность выпадения реакции подвержена колебаниям, но в большинстве случаев равняется 1 - 2 месяцам; в значительно более редких случаях реакция выпадает на 3 месяца либо вовсе утрачивается. Авторы подчёркивают, что, по их наблюдениям, периоды до и после абортов и отёлов оказывают известное влияние на повышение титров агглютинации, главным образом, послеабортальный период (21 - 28 дней), но иногда и предабортальный, преимущественно у коров, уже дававших раньше положительную реакцию агглютинации.
В настоящее время применяются два метода агглютинации: стандартно-пробирочный и ускоренный пластинчатый.
Первый состоит в том, что в совершенно чистые уленгутовские пробирки наливают сначала по 1 мл разведений испытуемых сывороток 1:50, 1:100 и 1:200 и к ним добавляют по 1 - 2 капли антигена. Контролем служит нормальная сыворотка соответствующего вида животного в аналогичных разведениях и физиологический раствор поваренной соли с добавлением тех же количеств антигена. Все пробирки, после встряхивания и превращения находящейся в них жидкости в равномерную муть, ставят в термостат при 37°С на 42 часа или же выдерживают до учёта 68 часов при комнатной температуре. Выдерживание в течение более короткого срока не даёт настоящего просветления жидкости с некоторыми сыворотками. Положительным признаётся такой результат, когда при полном просветлении жидкости на дне пробирки находится осадок, расположенный более или менее широко по дну пробирки с зигзагообразными выемками по окружности. Контроли должны быть безупречны в смысле отсутствия подобного же осадка, образования хлопьев; жидкость в них остаётся мутной.
Исследование ускоренным, или пластинчатым, методом агглютинации, по Хеддльсону, требует приспособления особого квадратного ящика со стеклянной крышкой. Ящик внутри окрашен в чёрный цвет и имеет по одной стенке две электрические лампочки, прикрытые в верхней части деревянной крышкой. На стеклянную пластинку, которая должна быть совершенно чистой, наносят рядами сначала капли испытуемых неразведённых сывороток в дозах 0,08, 0,04, 0,02, 0,01 (пипеткой, разделённой на сотые доли миллилитра), а затем к каждой капле сыворотки добавляют каплю концентрированного антигена и тщательно вмешивают с сывороткой при помощи обыкновенной деревянной зубочистки, начиная с самых малых количеств сыворотки и переходя к большим. Для разных сывороток берут отдельные зубочистки. По окончании процедуры стеклянную пластинку встряхивают, кладут на ящик и зажигают электрические лампочки.
Можно обойтись и без специального ящика. Обыкновенное чисто вымытое стекло кладут на подставки и в нужный момент подогревают спиртовой лампочкой. В отдельных странах почти исключительно пользуются этим методом агглютинации. Реакция наступает через 3 - 7 минут и хорошо заметна; в каплях с положительными сыворотками образуются мелкие комочки агглютинации, тогда как в отрицательных сыворотках остаётся прежняя равномерная муть. Разумеется, при каждом испытании следует ставить и контроля с нормальной сывороткой и физиологическим раствором с добавлением антигена. Указанные количества сывороток с антигеном соответствуют разведениям при стандартном методе 1:25, 1:50, 1:100 и 1:200. Таким ускоренным методом агглютинации можно испытывать и цельное молоко.
Ускоренный метод считают несколько менее надёжным, по сравнению с пробирочным.
Подобно агглютинации с сывороткой крови, можно ставить реакцию и с молочной сывороткой. Свежевзятые молочные пробы обрабатывают уксусной кислотой или (лучше) сычужным ферментом. При наступающем после этого створаживании молока отделяется прозрачная сыворотка, которую и исследуют аналогично сывороткам крови. Молочные сыворотки обычно показывают значительно более низкий титр агглютинации, чем сыворотки крови. Положительным результатом считается уже агглютинация в разведении 1:10 - 1:20.
Делались попытки определить бацилловыделение с молоком по высоте титра агглютинации с сыворотками крови и молока. Выводы отдельных авторов в этом отношении не совпадают. В большинстве случаев чем выше титр агглютинации, тем больше шансов, что данное животное выделяет бациллы Банга с молоком; бывают, однако, исключения.
Реакция связывания комплемента. РСК в качестве диагностического метода при бруцеллёзе также даёт хорошие результаты, но в некотором проценте случаев последние не совпадают с данными РА. На расхождение показаний обеих реакций нельзя смотреть как на ошибки того или другого метода. Каждая из этих реакций может в известном проценте случаев отсутствовать в тот или иной момент исследования крови животного; следовательно, обе реакции дополняют друг друга.
Некоторые авторы отдают предпочтение РСК перед РА и считают первую много надёжнее для диагностики бруцеллёза крупного рогатого скота.
Реакцию ставят так же, как и при сапе. Вследствие сложности эта реакция сравнительно редко используется для диагностики бруцеллёза.
Реакция аллергии. До недавнего времени для диагностики бруцеллёза применялся абортин Дюбуа и Солье (Франция) или различные его модификации.
Метод приготовления этого антигена чрезвычайно прост. Двухсуточную культуру br. abortus на агаре смывают физиологическим раствором поваренной соли с таким расчётом, чтобы в 1 мл эмульсии содержалось 2 млрд. микробных тел, после чего её подвергают нагреванию в течение 1 часа при 70°С, разливают в ампулы и запаивают. Препарат применяется внутрикожно, на одной из хвостовых складок на передней поверхности хвоста, в дозе 0,3. В СССР этот метод был несколько модифицирован.
Выраженность реакции аллергии при внутрикожном введении абортина как у крупного рогатого скота, так и у овец чрезвычайно резка и выпукла, и оценка результатов вполне доступна для неспециалиста; у коров величина опухоли после инъекции абортина (подхвостовая складка) колеблется в положительных случаях от размеров фасоли до куриного яйца; значительно меньшие максимальные размеры бывают у овец. Реакция у отдельных животных наступает уже через 24 часа; через 48 часов она выражена у большинства, а через 72 часа выявляются вообще все животные, способные отвечать на раздражение аллергеном. Учёт реакции в практике приурочивают к 48-му и 72-му часу. Реакция держится и дольше, медленно спадая.
При ясно выраженной реакции наблюдается покраснение, жар и некоторая болезненность припухлости. Последняя отёчна, более или менее плотна на ощупь, большей частью резко контурирована, иногда разлита. В сомнительных случаях припухлости через 48 - 72 часа немного превышают величину горошины, не болезненны и не горячи. Положительной реакцией нужно считать припухлость величиной не менее фасоли, длительно сохраняющуюся (не менее 72 часов), вместе с другими признаками реакции (покраснение, болезненность, жар). У некоторых животных через 24 часа после введения абортина наблюдаются отёчные припухлости величиной до фасоли, исчезающие к 48 часам, а также небольшие холодные затвердения на месте инъекции абортина, величиной с горошину, которые длительно не рассасываются, но не имеют специфического значения.
Если абортин вводят не в подхвостовую складку, то предварительно измеряют толщину складки кожи; то же самое следует проделать при учёте реакции через 72 часа после инъекции абортина. Утолщение кожной складки на 7 мм и больше считается положительной реакцией, меньшее утолщение (4 - 7 мм) признаётся сомнительной реакцией, а ещё меньшее увеличение рассматривается как отрицательный результат.
С 1938 г. абортин введён в СССР как диагностический препарат для распознавания скрытых форм бруцеллёза крупного рогатого скота. Изготовление абортйна несколько изменено. Концентрация бруцелл в 1 мл уменьшена вдвое. Нагревание после изготовления взвеси бактерий в стерильном физиологическом растворе производят дважды, по 30 минут, при 100°С. После, первого нагревания бруцеллы отмывают физиологическим раствором, или на центрифуге, или путём отстаивания. Дальше следует разливка по ампулам, новое нагревание и запаивание.
При проверке специфичности абортина и чувствительности к нему бруцеллёзного и здорового скота, предварительно исследованного реакцией Райта, оказалось, что у здорового скота абортин реакций не вызывает. В бруцеллёзных же хозяйствах (со старой инфекцией) абортин выявляет высокий процент положительно реагирующих животных, которые утратили реакцию агглютинации.
Такие же итоги с абортином получились в результате противобруцеллёзной кампании, охватившей свыше миллиона животных: в старых сильно заражённых бруцеллёзных хозяйствах большинство животных дало положительную реакцию на абортин, утратив РА или обнаружив её в низком (не патологическом) титре. Словом, подтвердилось то, что в своё время исследователь Хеддльсон охарактеризовал следующими словами: "Главное затруднение для применения какой-либо аллергической пробы в диагностике бруцеллёза крупного рогатого скота состоит в том, что животные, выздоровевшие от инфекции, продолжают давать реакцию, сходную по своей природе с таковой у животных с активным бруцеллёзом".
Такие результаты, отмеченные различными работниками, делают аллергическую пробу без дополнительных диагностических контролей неудовлетворительной. Контролем, уточняющим диагностические выводы показаний реакции аллергии, некоторые считают опсоноцитофагическии показатель крови.
Динамика развития реакций агглютинации, связывания комплемента и аллергии в организме бруцеллёзных морских свинок и крупного рогатого скота представляется в следующем виде. Раньше других в организме заболевшего бруцеллёзом животного появляется РА, за ней следует РСК и последней возникает реакция аллергии. Следовательно, в свежеинфицированном бруцеллёзном стаде должно быть больше животных с положительной и сомнительной РА, а в давно зараялённом стаде - меньше, но зато гораздо больше "аллергенщиков" (Бессонов).
По этой теории выпадение РА обозначает затухание инфекции. Наличие у животных РСК и аллергии при выпавшей РА говорит о неполном затухании инфекции, но такие животные уже мало опасны как распространители бруцеллёза. Животные, утратившие обе серореакции (РА и РСК) и сохранившие одну реакцию аллергии, должны быть признаны здоровыми, освободившимися от инфекции. По положительным результатам аллергии при отрицательных РА и РСК мы можем судить лишь о вйздороцлении стада и о том, что оно было неблагополучным в прошлом. Из-за этих особенностей абортин почти вышел из употребления. Однако у отдельных, реагирующих только по аллергии животных может оставаться дремлющая инфекция, приводящая к обострению бруцеллёза при ослаблении организма разными причинами.
Самовыздоровление от бруцеллёза наблюдалось не раз зарубежными авторами, особенно в небольших хозяйствах крупного рогатого скота, которые не пополнялись со стороны. В СССР рядом исследований последних лет доказано самовыздоровление свыше 50% болевшего бруцеллёзом крупного рогатого скота. При проверке скота в специальных бруцеллёзных изоляторах через 2 - 4 года после его выделения оказалось, что до 80% животных перестало реагировать по РА. Чем больше времени проходит после выделения в изолятор, тем большее число бруцеллёзных животных утрачивает РА.
Что с утратой РА и РСК наступает выздоровление, доказано специальными опытами и наблюдениями. У таких животных проверяли молоко и выделения из родовых путей, подвергали тщательному бактериологическому исследованию материал из органов туш, присоединяли к коровам, утратившим РА, здоровых нетелей и убеждались в отсутствии у последних бруцеллёза, так как они после случки благополучно телились, а посевы на средах и заражение морских свинок были безрезультатны (Савельев, Дион, Бессонов, Николаев).
Лечение бруцеллёза, несмотря на массу испытанных средств, пока не дало результатов и не сопровождалось ясным и определённым успехом в ветеринарной медицине.
В Швейцарии людей успешно лечат препаратом "causyth", представляющим комбинацию пирамидона и сернохинолиновой кислоты.
Продолжительные дачи per os искусственно заражённым козам сульфаниламида оказывают, повидимому, известное влияние на течение бруцеллёзной инфекции; у коз, которые выделяли бацилл Ванга, последние исчезали из молока после обработки сульфаниламидом. У лошадей применяли для лечения вскрывшихся бруцеллёзных абсцессов антивирус или убитую бруцеллёзную вакцину.
Меры борьбы. Общепринятым методом борьбы с бруцеллёзом крупного рогатого скота является проверка заражённых стад реакцией агглютинации с последующим выделением в изолятор всех положительно реагирующих животных. Животные, давшие дважды сомнительную реакцию в разведении сыворотки 1:50, также изолируются.
В США этот способ известен как "метод контроля и убоя", так как там в большинстве случаев не довольствуются изоляцией реагирующих животных, а отправляют их на убой, устраняя этим очаги инфекции и сокращая заботы и расходы по изоляции, уходу за больными, по дезинфекции, пастеризации молока. Благодаря этим мерам, в США за 10 лет бруцеллёз крупного рогатого скота сократился на 50%. Но метод этот оказался дорогим и нерезультативным в крупных хозяйствах с застарелой инфекцией. В таких американских хозяйствах практикуют вакцинацию молодняка, а иногда и взрослого" скота, что облегчает ликвидацию бруцеллёза.
Дополнительными мерами к методу проверки и изоляции положительно реагирующих животных служат: периодическая дезинфекция помещений и скотных дворов, организация абортариев и родильных помещений, а также межколхозных и совхозных изоляторов для выделяемого бруцеллёзного скота.
Много внимания уделяют вопросу изолированного выращивания молодняка из бруцеллёзных хозяйств для получения молодого здорового стада. Для телят, отнимаемых от бруцеллёзных и благополучных матерей-коров, создают профилактории; отводят обособленные фермы для молодняка 10 - 12-месячного возраста, в частности, для тёлок, приближающихся к половозрелому возрасту и особенно восприимчивых к инфекции.
В СССР борьба с бруцеллёзом проводится согласно соответствующей инструкции.
После установления в совхозе или колхозе бактериологического или серологического диагноза на бруцеллёз крупного рогатого скота, необходимы прежде всего точная регистрация животных и проверка всего стада по реакции агглютинации. На основании результатов исследования, животных разделяют на положительно реагирующих - бруцеллёзных, и на нереагирующих - условно здоровых.
Положительно реагирующих животных немедленно изолируют. Из них ценных в племенном и продуктивном отношении сосредоточивают в специальных бруцеллёзных изоляторах (хозяйство, ферма, хутор) со строго обособленным от остального поголовья содержанием и эксплоатацией (отдельные пастбища и водопои). Бруцеллёзные изоляторы карантинируются и состоят на особом учёте.
Всех животных, не давших реакции агглютинации, лучше всего перевести в отдалённую изолированную фераду с предварительно дезинфицированными помещениями. Эти животные составляют условно благополучное стадо.
Условно благополучное стадо подвергают периодическим исследованиям по реакции Райта. Всех животных, выделенных с положительной серореакцией, направляют в бруцеллёзное стадо.
Молодняк от условно благополучных животных выращивают изолированно так же, как и в бруцеллёзном стаде, и после отрицательных показаний серологического исследования в 8 - 9-месячном возрасте переводят в благополучную группу молодняка старшего возраста.
Тщательная уборка навоза и ежедекадная дезинфекция имеют в условно благополучном стаде сугубое значение, так как задача состоит в том, чтобы искоренить заразу.
Санитарно-гигиенические мероприятия в неблагополучном стаде направляются, главным образом, к обеспечению безопасности людей, ухаживающих за скотом, а также к выращиванию здорового молодняка^ в хозяйстве же условно благополучном нужно, кроме этого, предотвратить дальнейшее перезаражение стада. Организация бруцеллёзных изоляторов - специализированных бруцеллёзных хозяйств - для выделяемых инфицированных животных является мерой, легко осуществимой только в условиях социалистической системы. Изоляция, устранение источников заразы и дезинфекция должны соблюдаться со всей строгостью.
В условно благополучном хозяйстве обязательно устройство родильного отделения, разделённого на две половины: одна - для абортирующих, другая - для телящихся в нормальный срок животных. Ветеринарный надзор должен строго следить за стельными животными и в случае появления предвестников аборта заблаговременно переводить соответствующих коров в родильное отделение. С телящимися в нормальный срок поступают так же, так как и у них не исключена возможность инфекции, и, следовательно, опасность распространения заразы, особенно повышающаяся во время отёлов.
При выкидыше немедленно подвергают дезинфекции стойло, где находилась абортировавшая корова; скинутый плод выносят в непроницаемом ящике и сжигают (лучше), а в крайнем случае зарывают в таком месте, где исключена опасность дальнейшего разноса заразы. Если необходим бактериологический диагноз, отправляют соответствующий материал, с соблюдением мер предосторожности против рассеивания заразы, в бактериологическую лабораторию. Абортировавшую корову подвергают двукратному исследованию на бруцеллёз. Если у неё произошло задержание последа и развился метрит с маточным истечением, её лечат. Матку промывают стерильным физиологическим раствором или 1% раствором соды, а также очень слабыми дезинфицирующими растворами лизола, марганцевокислого калия или йодной настойки. Когда маточное истечение прекращается, кожные покровы животного обмывают и дезинфицируют, особенно в задней части тела, где могло задержаться инфекционное начало. В дальнейшем с абортировавшей коровой поступают в зависимости от результатов исследования плода и животного.
В условно благополучном стаде следует иметь также особый изолятор, куда немедленно выводят всех животных, почему-либо заподозренных ветеринарным надзором в бруцеллёзной инфекции. Как только это подозрение подтверждается бактериологическими или серологическими (реакция агглютинации) исследованиями, такое животное переводят в заражённое стадо. Нельзя допускать привода в условно благополучное стадо животных со стороны, а в заражённое допускается лишь бруцеллёзный скот. Пастбища и водопой условно благополучного стада должны быть безупречными в смысле исключения опасности заражения бруцеллёзом.
Порядок случки бруцеллёзных и условно благополучных животных, а также записей их в госплемкнигу определяется специальной инструкцией.
Молоко из заражённого стада (бруцеллёзного изолятора), идущее в пищу населению или на производственные цели (маслоделие, сыроварение), выпускается после пастеризации или кипячения в самих хозяйствах. Приготовление масла разрешается только из пастеризированных сливок. Сыры должны выдерживаться после приготовления не менее 3 месяцев. Молоко и молочные продукты от коров условно благополучных групп, давших дважды отрицательный результат, выпускаются без ограничений. Опыт показал, что паллиативные меры (разделение стада на инфицированное и условно благополучное в одном и том же помещении, хотя бы отгороженном стеной, или в разных помещениях, но на одном и том же дворе) мало результативны и пе приводят к оздоровлению стада.
Чрезвычайно важно выявить благополучные по бруцеллёзу хозяйства, с тем чтобы охранить их от заноса инфекции и использовать здоровый скот в племенных и других целях. Перед второй мировой войной в СССР удалось ликвидировать бруцеллёз в ряде совхозов и колхозов. Систематические исследования крупного рогатого скота в бруцеллёзных хозяйствах с изъятием и удалением всех положительно реагирующих животных, а также изолированное выращивание молодняка принесли немалую пользу.
Предохранительные прививки. Для борьбы с бруцеллёзом за границей и отчасти в СССР в течение долгого ряда лет производились предохранительные прививки крупному рогатому скоту как убитыми, так, особенно, живыми культурами. Эти прививки в настоящее время имеют больше исторический, чем практический интерес, так как положительных результатов они не дали.
Прививки культурами br. abortus, предварительно убитыми путём нагревания или добавлением различных химических средств, получили отрицательную оценку в разных странах несколько раньше, чем прививки живыми культурами.
Применение живых культур создаёт у скота искусственное вирусоносительство. Исследования показали, что после подкожного заражения (а это и есть способ прививки) у животных наблюдается в очень большом проценте случаев выделение бацилл бруцеллёза с молоком. При прививках снижается процент абортов; однако это происходит и без прививок, по мере естественного перезаражения стада: в первый период развития бруцеллёза наблюг даются массовые аборты; с течением времени и постепенно нарастающим количеством заражённого маточного состава животные выздоравливают или становятся хрониками и больше не абортируют. Повторный выкидыш - явление редкое; трёхкратный аборт у одного и того же животного ещё более редок (однако имели место даже и более многократные случаи абортов).
Несмотря на разочарования, вызванные опытами прививок убитыми культурами, и в особенности на плачевные итоги долголетних прививок живыми культурами бруцеллёза, в настоящее время продолжаются настойчивые искания новых способов вакцинации против бруцеллёза. Среди предложенных методов более или менее значительное применение нашли вакцинация по Дюбуа во Франции и американским штаммом 19-м.
Дюбуа использует для вакцинации всех видов сельскохозяйственных животных штамм br. suis, по данным автора, представляющий авирулентную культуру.
Вакцина готовится по прописи:
Вазелинового масла 90,5
Ланолина 9,0
Ликоподия 0,5
Сухих бруцелл (br. suis 22) 0,25
Живая вакцина Дюбуа в трудно резорбируемом обволакивающем материале применяется во Франции с удовлетворительными результатами в сильно поражённых бруцеллёзом хозяйствах.
Полученная вакцина - штамм 19-й типа br. abortus - слабовирулентная культура, отличающаяся от обычных вирулентных штаммов естественного бруцеллёза тем, что она не проникает в вымя и не выделяется с молоком у привитых первотёлок и коров, т. е. не вызывает инфекции вымени. Штамм 19-й склонен к диссоциации, и возникающие колонии R-формы утрачивают иммунно-биологические свойства штамма.
Для предупреждения диссоциации штамм 19-й культивируется на картофельном агаре и после получения культуры проверяется трипафлавиновой пробой, устанавливающей излишек диссоциантов.
Штамм 19-й применяется у телят 4 - 8-месячного возраста. Длительность иммунитета ещё не определена. Привитый молодняк в половозрелом состоянии телится, за немногими исключениями, благополучно, даже находясь в окружении бруцеллёзного скота.
В США вакцина в последнее время используется против бруцеллёза как дополнительный способ к методу "контроля и убоя". Вакцины применяются только в сильно заражённых стадах, насчитывающих свыше 15% бруцеллёзных животных.
Процент абортов на почве бруцеллёза у коров, вакцинированных ещё телятами, составляет 1,1.
Вакцинация телят, а также взрослых животных не приводит к заражению здоровых животных этих стад штаммом 19-м. Вакцинацией взрослого скота установлено также, что в стадах, с ранее существовавшим в течение года или больше бруцеллёзом, немедленно остановить инфекцию не удаётся, но обработка предупреждает дальнейшее развитие болезни у многих предохранённых животных, в частности, у недавно случённых и не случённых тёлок.
В США считают противопоказанной вакцинацию взрослого здорового скота, предназначенного для молочной продукции, и, наоборот, она допускается в группах мясного скота, в особенности, где затруднено исследование крови. У коров, вакцинируемых в поздней стадии стельности (с 5-го месяца), могут быть выкидыши.
Недостатком американского штамма 19-го, как и других современных живых и убитых вакцин, является то обстоятельство, что он вызывает у привитых животных образование агглютининов, которые симулируют естественную инфекцию. Однако агглютинины у большинства привитых телят сохраняются до 4 месяцев, и лишь незначительный процент молодняка удерживает их более длительно (иногда до года). Вакцинация же взрослого скота, которая в США иногда практикуется, сопровождается образованием агглютининов до 2 лет и более.
Интрадермальный метод вакцинации значительно сокращает расход вакцины и ведёт к некоторому сокращению срока выработки агглютининов у молодняка.
Американская вакцина не может считаться совершенно безопасной. Не так давно американский студент, производивший вакцинацию телят, случайно впрыснул себе в глаз вакцину из шприца и через 16 дней заболел бруцеллёзом. Второй сообщённый в американской же литературе случай касается быка, у которого развился орхит на почве вакцинации. Если учесть к тому ещё возможности абортов и, в частности, аборты у стельных коров, при прививках на 5-м месяце и в более поздней стадии, то станет ясно, что случаи нежелательных исходов хоть и редки, но без них дело не обходится.
Мингль и Мантей последовательно провели 20-кратную дозу штамма 19-го через семь стельных коров путём интравенозных интенций. Все эти коровы абортировали, но пассажированная через них культура штамма 19-го не усилилась в своей вирулентности. Девять нормальных стельных коров, содержавшихся вместе с указанными экспериментальными коровами, не заразились от последних. Эти опыты говорят за безопасность штамма 19-го при прививках для соседних животных и за константность его слабовирулентных свойств.
Вакцинация штаммом 19-м молодняка, а частично и взрослого крупного рогатого скота, в настоящее время за рубежом признана серьёзным подсобным методом борьбы с бруцеллёзом.
Проверка американской вакцины (штамм 19-й) в СССР дала вполне удовлетворительные результаты на телятах и на взрослом крупном рогатом скоте, на основании чего рекомендовано применять её в сухом виде интрадермально, пока в порядке широких опытов.
Прививки крупного рогатого скота сопровождались повышением температуры и образованием на непродолжительный срок инфильтратов на месте инъекции.
У телят на месте инъекции вакцины появляется болезненная припухлость, рассасывающаяся в 10 - 15 дней. Температура повышается на 1 - 1,5° и держится на этом уровне три дня. Безопасность привитых животных для их здоровых соседей установлена на массовом материале. Однократной прививкой создаётся иммунитет к последующему массивному экспериментальному заражению (Путимов).
Образующиеся у телят в результате вакцинации агглютинины сохраняются в их организме недолго.
В СССР применяются также убитые вакцины: полужидкая агаровая бруцеллёзная формолвакцина, предложенная Муромцевым, и формол-квасцовая вакцина.
|
ПОИСК:
|
© ANIMALIALIB.RU, 2001-2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://animalialib.ru/ 'Животноводство'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://animalialib.ru/ 'Животноводство'