
Протозойные болезни
Кокцидиоз
Ооиисты кокцидий у кролика (в желчи) впервые наблюдал Левенгук в 1674 г. В 1838 г. Карсуэлл впервые описал кокцидиозное поражение у кролика. В 1839 г. Гейк подробно описал ооцист кокцидий, выделенных из печени кроликов, и привел их изображение. В кишечнике кролика ооцисты кокцидий впервые обнаружил Ремак в 1845 г.
В дальнейшем разными авторами было описано 10 видов кокцидий кроликов.
Этиология. Возбудители кокцидиоза кроликов - несколько видов кокцидий, относящихся к роду Eimeria, подсемейству Eimeriinae, семейству Eimeriidae, порядку Coccidiida, классу Sporosoa. Один из этих видов кокцидий- Eimeria stiedae (Coccidia oviforme Лейкарта) паразитирует в печени кролика и вызывает печеночный кокцидиоз; другие - в кишечнике и вызывают кишечный кокцидиоз. Обычно и тот и другие наблюдаются одновременно и у каждого кролика обнаруживается несколько видов кокцидий.
Кокцидий кролика обладают строгой специфичностью к своему хозяину, а разные виды их - и к отдельным его органам, что обусловливает абсолютный видовой иммунитет к кроличьему кокцидиозу у других видов животных и определенную локализацию разных видов кроличьих кокцидий в организме кролика. Так, например, Е. stiedae паразитирует только в желчных путях; по данным Е. М. Хейсина, Е. magna - в нижней части тонкого кишечника, Е. media и Е. irresidua - в передней части дуоденум, Е. perforans - в средней части тонкого кишечника (1937), Е. piriformis - в червеобразном отростке, слепой и толстой кишках (1941).
Цикл развития указанных кокцидий весьма сложен, но у всех видов почти аналогичен (за исключением отдельных деталей), они проходят спорогонию, шизогонию и гаметогонию (рис. 19).
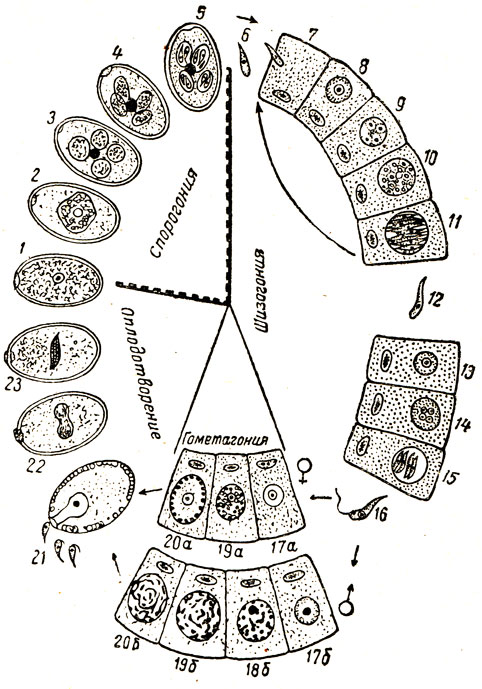
Рис. 19. Схема развития кокцидий: 1 - 5 - спорогония во внешней среде; 1 - 2 - ооциста; 3 - 4 - в ооцисте образуются четыре споробласта; в каждом споробласте образуется по два спорозоита; б - спорозоит внедряется в кишечную клетку (7) и начинается бесполовой цикл развития - шизогония (8 - 11), 12 - мерозоит; 13 - 15 - начало образования половых особей; 16 - гаметозоит; 17 - 20 - гаметогония: 17а, 19а, 20а - развитие макрогаметоцитов; 17б - 20б - развитие микрогаметоцитов; 21 - 23 - фазы оплодотворения
Спорогония. В выделившихся из организма кролика ооцистах кокцидий образуется шар, разделяющийся затем на четыре круглых или овальных споробласта, которые покрываются оболочкой и превращаются в спороцисты (споры). В каждой спороцисте образуется по два агорозоита, имеющих удлиненно-грушевидную, форму. Кроме того, у одних видов кокцидий в ооцисте между спороцистами и в спороцистах образуется так называемое остаточное тело (у других видов оно образуется только в спороцистах, у третьих - только между ними). Продолжительность спорогонии у разных видов кокцидий неодинакова; при благоприятных условиях (влажность, температура 20 - 30°) она колеблется от 30 - 40 часов (Е. perforans) до 60 - 70 часов (Е. stiedae), при неблагоприятных условиях - 4 - 6 дней.
По окончании спорогонии ооциста становится способной заражать кролика при попадании в его пищеварительный тракт. Общее количество выделяемых ооцист кокцидий, образующихся из одной заразившей кролика ооцисты, составляет, по Е. М. Хейсину, у Е. magna 800 000, у Е. media 150 000, у Е. perforans 50 000, у Е. irresidua 200 000.
Шизогония. Из попавших в пищеварительный тракт кролика спорулировавших ооцист (оболочка их разрушается пищеварительными соками) выходят спорозоиты и внедряются в эпителиальные клетки слизистой оболочки кишечника или желчных путей печени (куда они проникают из двенадцатиперстной кишки через желчный проток или заносятся кровью), где быстро растут и округляются. При этом ядро и протоплазма их несколько раз делятся, образуется от 6 до 30 мерозоитов первой генерации. Эпителиальная клетка разрывается, мерозоиты внедряются в соседние клетки, вырастают в шизонты, ядро и протоплазма которых снова делятся, образуя мерозоитов второй генерации, и т. д. Этот круг развития может повторяться несколько раз, после чего мерозоиты начинают превращаться в половые формы; женские - макрогаметоииты (они затем развиваются в макрогаметы) и мужские - микрогаметоциты. Образованием половых форм заканчивается стадия шизогонии и сменяется гаметогонией.
Гаметогония. В макрогамете развивается ядро с кариозомой в центре и зернистой протоплазмой, окруженной оболочкой. В микрогаметопите из ядра образуется значительное количество подвижных микрогамет с двумя жгутиками на одном конце. Микрогаметы выходят в просвет кишечника или желчных путей, протекают в макрогаметы и оплодотворяют их, образуются ооцисты, которые выделяются из организма кроликов с калом. Образованием ооцист заканчивается стадия гаметогонии и сменяется спорогонией.
Промежуток времени (в днях) от заражения кролика до появления ооцист в выделяемом им кале (препотентный период) и от начала до прекращения выделения ооцист с калом (потентный период) у разных видов кишечных кокцидий кролика следующий (по Е. М. Хейсину, 1941):

При интенсивном заражении продолжительность препотентного периода на несколько часов уменьшается, потентного увеличивается. У взрослых кроликов препотентный период больше, потентный период и количество выделяемых ооцист кокцидий меньше, чем у молодых. Наибольшее количество ооцист выделяется на второй день потентного периода.
Для отличия отдельных видов кокцидий необходимо учитывать размер, форму и цвет ооцист, спороцист, остаточных тел, шизонтов и мерозоитов (рис. 20).
Ооцисты кокцидий весьма устойчивы к воздействиям внешней среды: быстро (5 - 10 секунд) убивает их только высокая температура 80 - 100°, при 55° они погибают через 15 минут. При температуре ниже 0° и в анаэробных условиях споруляция ооцист не происходит, при -15° часть их погибает; попеременные замораживания и оттаивания губительно действуют на них. Дезинфицирующие (химические) средства и газы действуют на ооцист слабо и только при большой экспозиции, поэтому их не используют для дезинфекции.
Восприимчивость. Кроличьими кокцидиями заражаются только кролики. Наиболее восприимчив молодняк до 3 - 4-месячного возраста.
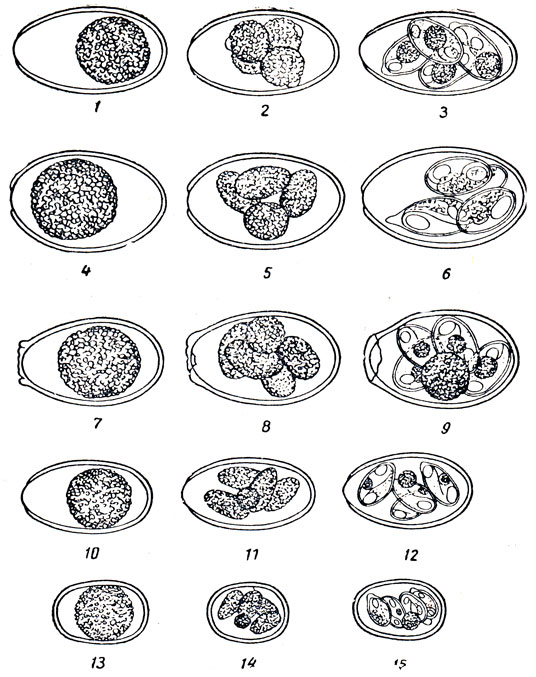
Рис. 20. Ооцисты разных видов кокцидий: 1, 2, 3 - незрелая, полузрелая и зрелая (спорулировавшая) ооциста Eimeria stidae; 4, 5, 6 - то же, Eimeria irrisidua; 8, 9 - то же, Eimeria magna, 10, 11, 12 - то же, Eimeria media; 13, 14 15 - то же Fimeria perforans
Эпизоотологические данные. Болезнь наблюдается повсеместно и весьма широко распространена в кролиководческих хозяйствах. Исследования, проведенные многими авторами, показали, что все кролики заражены кокцидиями и выделяют ооцист. Это обусловливается тем, что крольчата с первого дня рождения постоянно заглатывают ооцист кокцидий (С. В. Леонтюк, 1951), вначале при сосании молока с загрязненных сосков матери, а затем с кормом и водой, загрязненны - и калом, содержащим ооцист кокцидий, а также при опрофагии (поедании кала). Заражение происходит олщо через пищеварительный тракт. Следовательно, основным эпизоотологическим фактором, приводящим к заражению кроликов кокцидиями, является наличие в клетках, выгулах и других помещениях для кроликов кала и загрязненных им кормов, воды и предметов более 24 часов, т. е. дольше срока, необходимого для прохождения спорогонии выделенных с калом ооцист.
Необходимо иметь в виду, что факт зараженности кролика кокцидиями не равнозначен заболеванию его кокцидиозом при понимании болезни как состояния организма, характеризующегося нарушением тех или иных его функций и клиническими проявлениями.
Вследствие присущей каждому организму способности постоянной регенерации отмирающих клеток, обезвреживания и удаления многих ядовитых веществ, в том числе и продуктов распада белка, разрушаемые кокцидиями клетки организма кролика (если их количество не превышает его регенеративных возможностей) заменяются вновь образующимися без нарушения его функций, а указанные ядовитые вещества обезвреживаются и удаляются. При этом общее состояние кролика не нарушается, и он является клинически здоровым. Кокцидиоз как болезнь проявляется только в том случае, когда количество разрушаемых кокцидиями клеток, а также выделяемых этими паразитами и образующихся в организме кролика ядовитых веществ превышает возможности защитных функций его.
Количество разрушаемых кокцидиями клеток зависит от интенсивности заражения и защитных функций организма. По данным J. Chapman (1929) и А. И. Осиповского (1936), клиническое проявление кокцидиоза обнаруживается при заражении не менее чем 100 000 спорулировавшими ооцистами кокцидий.
Основным фактором, влияющим на интенсивность заражения кроликов кокцидиями, являются условия их содержания; при соблюдении чистоты зараженность меньше, в противном случае - больше.
Уровень регенеративных способностей и защитных функций кролика, его реактивности зависит от полноценности физиологического состояния организма в данный момент и индивидуальных его особенностей. Поэтому все факторы, ослабляющие резистентность организм кроликов и прямо или косвенно способствующие развитию кокцидий, являются предрасполагающими к клиническому проявлению кокцидиоза.
Важнейшие из них следующие:
1) недостаточная полноценность кормового ратшона по его питательности, наличию витаминов А, В, В1 С, D и минеральных солей;
2) односторонний перенасыщенный белком тип кормления. Он способствует развитию кокиидий и накоплению в организме кролика большого количества ядовитых, недоокисленных продуктов распада белка; углеводный же тип кормления оказывает обратное действие (С. В. Леонтюк, 1954; Н. П. Орлов, 1947, 1957);
3) включение в рацион молодняка кормов, содержащих вещества, способствующие развитию кокцидий.- так называемых кокцидиобиозов (Е. А. Беккер, 1919). К их числу относятся пшеничные и люцерновые отруби, сухое снятое или жирное молоко, витамины В6 и G;
4) недоброкачественность кормов, резкая их смена и другие нарушения гигиены кормления, приводящие к расстройству функций, возникновению заболеваний пищеварительного тракта, наслаивающихся на латентно протекающий кокцидиозный процесс и обостряющих его;
5) скученное содержание молодняка и неправильное комплектование его групп (включение в них животных разного возраста и развития), что приводит к недокорму более молодых и слабых животных и затрудняет моцион и поддержание чистоты;
6) другие факторы, неблагоприятно влияющие на общее физиологическое состояние организма кролика и снижающие его резистентность (сквозняки, намокание, сырость, резкие колебания температуры, другие болезни и т. д.).
Инкубационный период 2 - 3 дня.
Патогенез. Патогенное воздействие кокцидий на организм кролика заключается в разрушении эпителиальных клеток слизистой оболочки кишечника и желчных путей в период прохождения шизогонии и гаметогонии и в отравлении организма выделяемыми кокцидиями токсинами (по одним авторам) или ядовитыми веществами, образующимися под влиянием микрофлоры и интенсивных протеолитических процессов, усиливающихся распадом разрушенных кокцидиями эпителиальных клеток (по другим авторам).
Разрушение клеток слизистой оболочки кишечника вызывает воспалительный процесс и нарушение секреторных функций. Поражение желчных путей приводит к их запустению, закупорке, застою желчи, сильному развитию соединительной ткани.
В результате указанного резко снижается переваривающая сила пищеварительных соков, корма перевариваются не полностью.
Н. Н. Озерский с сотр. (1933) считают, что при поражении кишечника кокцидиями кишечный кокцидиоз кроликов (клиническое его проявление) является вторичным заболеванием, обусловленным энтероколитом, возникшим от алиментарных расстройств питания. По данным С. В. Леонтюка (1945), при кишечном кокцидиозе у кроликов резко снижаются окислительно-восстановительные процессы в кишечнике и переваривание белка и крахмала дуоденальным соком; при печеночном кокцидиозе - переваривание крахмала. Нарушение функций пищеварения приводит к усилению протеолитических процессов и образованию большого количества ядовитых, недоокисленных продуктов распада белка, которые накапливаются в кишечнике и через воспаленную стенку кишечника и пораженные его участки попадают в организм кролика и отравляют его. В результате у больных кроликов расстраивается пищеварение, появляются диарея, метеоризм, нередко полиурия и желтуха, иногда нервные явления, кролики худеют и гибнут.
Интенсивность указанных процессов, характер течения, признаки болезни и их выраженность могут быть различны; они обусловливаются силой и интенсивностью двух противоположных процессов в организме кролика: процесса размножения паразитов, разрушения ими клеток и отравления организма кролика и процесса задержки развития паразитов, их уничтожения, образования новых клеток взамен разрушенных, обезвреживания и удаления ядовитых веществ.
Соотношение силы и интенсивность этих постоянно протекающих в организме кролика процессов определяют его кокцидиозное состояние. При доминировании процессов разрушения нарушаются функции организма кролика и заболевание его кокцидиозом проявляется клиническими признаками. При взаимной уравновешенности этих процессов или доминировании процессов восстановления и зашиты болезнь протекает скрыто, не приводит к изменению функций организма кролика, и он является клинически здоровым. Поэтому огромную роль в патогенезе заболевания играют факторы, воздействующие на эти процессы. Основные из них это биофизико-химическая среда организма в местах локализации паразитов, являющаяся для них внешней средой, могущей способствовать их развитию или тормозить его, и защитные силы организма, в том числе его регенеративные способности. Эти факторы, в свою очередь, зависят от степени физиологической полноценности организма кролика и условий его существования, в первую очередь от условий кормления и содержания.
При кокцидиозе кроликов отмечается ярко выраженный возрастной иммунитет. Природа его точно не выяснена; по-видимому, он обусловливается изменением с возрастом кролика биофизико-химической среды его организма, являющейся средой обитания паразитов, в сторону ее несоответствия их потребностям и инфекционным иммунитетом, т. е. специфическими иммунологическими процессами (активацией защитных сил организма и выработкой специфических защитных веществ), возникающими в результате воздействия паразитов на организм крольчат и поддерживаемыми постоянным наличием кокцидий в организме в последующее время. Н. Н. Голиков (1939) установил, что у крольчат 1 - 2-месячного возраста в кишечнике доминирует шелочеобразуюшая флора, способствующая развитию кокцидий, а у взрослых кроликов - кислотообразующая, подавляющая их развитие. Некоторые авторы указывают на образование у кроликов строго специфического иммунитета к отдельным видам кокцидий.
Симптоматика. Кишечный кокцидиоз. При остром течении болезни, которое чаще всего бывает у крольчат 20 - 60-дневного возраста, наблюдается понос, особенно летом при даче зеленых кормов, или выделение мягкого кала. Временами понос может прекращаться, затем появляется вновь. Часто наблюдается вздутие. Кролики плохо едят, отстают в росте, худеют, волосяной покров их становится взъерошенным, матовым, живот увеличен, отвисает; кролики истощаются и погибают через 10 - 15 дней. Иногда кролик внезапно падает, голова его запрокидывается на спину, появляются судороги, и кролик погибает.
При менее остром течении болезни указанные признаки выражены слабее, часть животных выживает, и болезнь приобретает скрытое (латентное) течение, клинически кролики выздоравливают.

Рис. 21. Кокцидиоз. Пораженный кишечник
Печеночный кокцидиоз. Болезнь протекает хронически, длится 30 - 50 дней. Признаки ее те же, что и при кишечном кокцидиозе, но менее выражены. Кроме того, иногда наблюдается желтушность слизистых оболочек ротовой полости и век. Отмечается вздутие живота. Кролики гибнут при выраженном истощении.
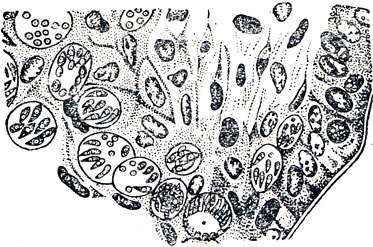
Рис. 22. Кокцидии в разных стадиях развития в эпителиальных клетках кишечника (срез кишечника)
Патологоанатомические изменения. Кишечный кокцидиоз. При вскрытии обнаруживают большое количество мелких (величиной от макового до просяного зерна) беловатых узелков, просвечивающих сквозь серозную оболочку тонких кишок и червеобразного отростка (рис. 21) В узелках находится большое количество оопист кокиидий. Слизистая оболочка тонких кишок покрасневшая, местами отслаивается; содержимое кишок жидкое, иногда с пузырьками газа, часто наблюдается скопление газов в слепой и ободочной кишках; содержимое в них тоже обычно жидкое. Червеобразный отросток нередко увеличен Мочевой пузырь часто наполнен мочой, иногда сильно растянут.
При гистологическом исследовании пораженного кокцидиозом кишечника в клетках эпителия его стенки и желез обнаруживают массу кокцидии в разных стадиях эндогенного развития (рис. 22). Пораженные клетки в разных стадиях разрушения
Печеночный кокцидиоз. В печени обнаруживают белые величиной от просяного зерна до горошины, не выдающиеся над ее поверхностью узелки или нити (тяжи) (рис. 23). Количество их различно, зависит от степени поражения. Содержимое недавно образовавшихся узелков имеет вид сметанообразной массы, в которой при исследовании под микроскопом обнаруживают большое количество ооцист кокцидии В давно образовавшихся (старых) узелках содержимое имеет вид сухой творожистой массы, в которой под микроскопом обнаруживают деформированные или разрушенные оонисты кокцидии (в очень старых очагах их часто не удается обнаружить). Слизистая оболочка тонких кишок покрасневшая, содержимое их нередко жидкое, Иногда в слепой кишке скопление газов.
На срезах в кокцидиозных узлах печени находят расшренные желчные протоки и разрастание соединительной ткани и эпителия их стенок. Вследствие этого они толщены и внутрь протоков со всех сторон вдаются осочковидные выступы, местами перегораживающие роток и образующие в нем отдельные маленькие полости. В эпителиальных клетках слизистой оболочки желчных протоков (в том числе и образовавшихся выступов) обнаруживают шизонты, макро- и микрогаметоциты. Часть эпителиальных клеток в стадии омертвения (пикноз, кариорексис ядра) (рис. 24).
Основная масса кокцидиозного узелка состоит из ооцист, шизонтов, гаметоцитов и разрушившихся эпителиальных клеток; встречаются в ней (значительно реже) макрогаметы, спороцисты и мерозоиты.
В паренхиме печени увеличение интерлобулярной соединительной ткани, атрофия печеночных клеток (в результате давления). Изредка заметна картина выздоровления: распад кокцидий, образование детрита, обызвествление узлов и превращение их в мозолистую рубцовую ткань. Гайндль (1910) наблюдал омертвение эпителия и соединительной ткани желчных протоков с одновременным развитием рубцовой ткани, приводившим к зарастанию пораженных кокцидиями ходов.
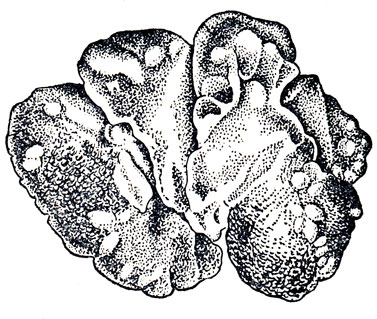
Рис. 23. Кокцидиоз. Пораженная печень
Диагноз. Клинические признаки болезни при кишечном и печеночном кокцидиозе не характерны. Наличие большого количества больного молодняка с указанными признаками при отсутствии (или единичных случаях) заболеваний взрослых кроликов дает основание подозревать кокцидиоз. Вскрытие павших или вынужденно убитых кроликов дает возможность установить диагноз, так как патологоанатомическая картина достаточно характерна.
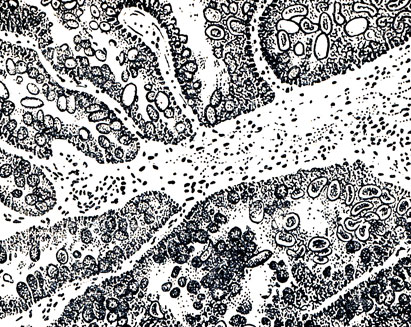
Рис. 24. Кокцидии в желчных протоках пораженной печени
Необходимо иметь в виду, что незначительные кокцидиозные поражения (небольшое количество узлов в кишечнике и печени) могут быть обнаружены у многих клинически здоровых кроликов. Поэтому диагноз на кокцидиоз как причину заболевания или смерти кролика можно поставить только в том случае, когда кокцидиозные поражения настолько значительны, что могли вызвать заболевание или смерть кролика. Наличие оонист кокцидий в кале кролика не является показателем его болезни, а указывает только на зараженность кокцидиями (которыми заражены все кролики). Количество ооцист кокций в кале весьма резко колеблется по дням: максимальное количество их выделяется через каждые 2 - 3 дня, в зависимости от прохождения эндогенных стадий развития паразита, и не является показателем степени поражения кишечника или печени, так как этот показатель зависит не только от интенсивности заражения, но и от уровня регенеративных и защитных функций организма кролика. Следовательно, рассматривать наличие ооцист в кале кролика как диагностический показатель заболевания кокцидиозом, а количество их как показатель его степени необоснованно. По количеству ооцист кокцидий в кале ориентировочно можно судить только об интенсивности заражения, причем только на основании ежедневных копрологических исследований на протяжений 5 - 6 дней.
Дифференциальный диагноз. В случае сомнения в этиологической природе обнаруженных узелков (они могут быть сходны с псевдотуберкулезными, туберкулезными, некробациллезными и др.) нужно провести их микроскопическое исследование - обнаружение ооцист кокцидий решает вопрос.
Лечение. Для лечения больных кокцидиозом кроликов было испытано и предложено много средств. При тщательной экспериментальной проверке наиболее эффективными оказались следующие, обеспечивающие почти полное освобождение кроликов от кокцидий:
а) дача с увлажненным кормом один раз в день сульфадиметоксина (мадрибона) в следующих дозах на 1 кг веса кролика: первый день - 0,2 г, последующие четыре дня - 0,1 г. После 5-дневного перерыва курс лечения повторяют (И. Ц. Дондуков, 1970);
б) ежедневная однократная дача в течение пять дней в расчете на 1 кг веса кролика 0,4 г норсульфазола в виде 0,5 - 1%-ного водного или молочного раствора и 0,1 г фталазола или 0,2 - 0,3 г дисульфана с увлажненным кормом. После 5-дневного перерыва курс лечения повторяют (А. Ф. Носик, 1956). Н. М. Лапшин (1968) рекомендует применять эти лекарства в течение десяти дней подряд, причем норсульфазол давать вместо воды в виде 1%-ного водного раствора из расчета 0,3 г, а фталазол с кормом из расчета 0,1 г на 1 кг веса кролика;
в) ежедневная в течение семи дней однократная дача фуразолидона в дозе 30 мг на 1 кг веса (В. Г. Несмашная, 1969) или 2 раза в день в течение десяти дней в дозе 20 мг на 1 кг веса кролика (Н. М. Лапшин, 1968).
Н. М. Лапшин (1968), проведя сравнительную оценку эффективности ряда препаратов, рекомендует применять десять дней подряд следующие: зоален с кормом раз в день в дозе 250 мг на 1 кг корма; трихазол (нитазол) 2 раза в день по 10 мг на 1 кг веса кролика; белый стрептоцид 2 раза в день в дозе 200 мг; сульфадимезин раз в день в дозе 150 мг, левомицетин раз вдень в дозе 40 мг и комбинации фуразолидона 20 мг с норсульфазолом - 0,5%-ный водный раствор вместо воды и трихазола 10 мг на 1 кг веса кролика с норсульфазолом - 0,5%-ный водный раствор вместо воды.
В. Г. Несмашная (1969) получила хороший эффект от применения в течение семи дней 0,5%-ного раствора коллоидной серы взамен воды. Н. М. Лапшин и В. Г. Несмашная советуют в целях профилактики применять эти препараты всему отсаженному молодняку в течение 10 дней подряд и повторять их дачу 2 - 3 раза с 6 - 7-дневными интервалами.
Положительный терапевтический эффект (снижение падежа в 5 - 7 раз) при незначительном уменьшении выделения ооцист кокцидий дает дача растворов настойки йода, окисляющих (обезвреживающих) недоокисленные токсические продукты распада белка. Их дают утром взамен воды до кормления по следующей схеме: самкам с 25-го дня беременности по 5-й день лактации 100 мл 0,1 %-ного раствора настойки йода; с 10-го по 25-й день лактации по 200 мл 0,2%-ного раствора; с 30-го по 40-й день лактации по 300 мл 0,1%-ного раствора. Отсаженным крольчатам с 45-до 60-дневного возраста - вначале по 70 мл, а затем по 100 мл 0,2%-ного раствора и с 70-до 85-дневного возрастало 100 мл 0,1 %-ного раствора. Отсаженным крольчатам, которые не получали растворов, находясь под самкой, дают их по той же схеме, но начиная с 0,1%-ного раствора настойки йода.
Растворы настойки йода нужно готовить непосредственно перед дачей (для приготовления 0,1%-ного раствора в 1 л воды вливают 1 мл 10%-ной или 2 мл 5%-ной настойки йода; для приготовления 0,2%-ного раствора - вдвое больше). Готовить и раздавать растворы в металлической посуде нельзя (С. В. Леонтюк, 1953 - 1955).
Меры борьбы и профилактика. Для предупреждения кокцидиоза у кроликов основное значение имеют: максимальное устранение возможности поедания кроликами фецес, загрязненных ими кормов и воды и недопущение воздействия предрасполагающих к заболеванию факторов
Поэтому в неблагополучных по кокцидиозу хозяйствах прежде всего необходимо проверить условия содержания и кормление кроликов и устранить выявленные недостатки. Перед окролом самок их клетки и инвентарь необходимо тщательно очистить и продезинфицировать; отсаживать молодняк нужно также в предварительно очищенные и тщательно продезинфицированные клетки.
Самок и их молодняк после отсадки лучше всего содержать в клетках с сетчатым полом (размер ячеек 15x15 - 18x18). Нужно применять только наружные кормушки и поилки с решетками (прутьями, расположенными поперек их на расстоянии 6 см), предотвращающими возможность залезания в них крольчат. Лучше всего применять автоматические поилки. При выявлении в группах молодняка клинически больных кокцидиозом кроликов их нужно выделить, сгруппировать в отдельные изолированные клетки и лечить. Если заболело значительное количество молодняка, нужно лечить поголовье всего стада.
Клетки и инвентарь дезинфицируют кипящим зольным щелоком или кипящей водой; металлические предметы - огнем паяльной лампы или кипячением в воде. Для дезинфекции можно также использовать карболо-вокеросиновую эмульсию (4% карболовой кислоты, 10% керосина, 5% креолина, 81% воды). Расход 0,5 л на 1 м2.
Вывоз кроликов с клиническими признаками кокцидиоза запрещается. К клиническим признакам, вызывающим это ограничение, не относится наличие ооцист кокцидий в кале.
Тушки, шкурки и пух убитых больных и павших от кокцидиоза кроликов никаким ограничениям не подлежат; пораженные кишечник и печень уничтожают.
|
ПОИСК:
|
© ANIMALIALIB.RU, 2001-2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://animalialib.ru/ 'Животноводство'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://animalialib.ru/ 'Животноводство'